写出下列反应的化学方程式。
(1)苯与液溴发生取代反应________________
(2)制乙酸乙酯的反应________________
(3)在苯酚钠溶液中通入过量的二氧化碳气体________________
(4)苯酚溶液与溴水的反应___________________________
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是___________________________________
_________________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:42—
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1。
根据表中数据解释步骤Ⅱ的目的____________________________________。
(4)已知:一定条件下,MnO4—可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是
_________________________________________________________________。
②Ⅳ中加入MnSO4的目的是______________________________________。
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题: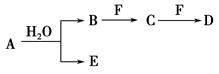
(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:______________________________________________。
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为________;D中所含化学键的类型为________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的式量相等,请用离子方程式表示F的水溶液呈酸性的原因:_______________________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的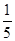 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
B转化为C的化学方程式为_______________________________________。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 |
| C.只有氧化性 | D.氧化性和酸性 |
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取ClO2的新工艺。
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为_____________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:______________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________________;处理100 m3这种污水,至少需要ClO2________mol。
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:__________________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: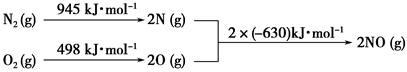
①写出该反应的热化学方程式:_______________________________。
②随温度升高,该反应化学平衡常数的变化趋势是____。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:______________________________
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是___________________________________________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下: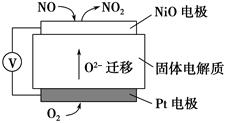
①Pt电极上发生的是________反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:______________________________________。
一同学分析硫元素的化合价有-2、0、+4、+6,而硫单质处于中间价态,所以硫应该既有氧化性,又有还原性。该同学欲探究硫的还原性,下面是该同学的实验探究过程,请解答其中的问题。
(1)该同学应该选择________(填“氧化剂”或“还原剂”)进行实验探究。
(2)该同学用红热的玻璃棒引燃了石棉网上的硫粉,硫粉开始燃烧,反应的化学方程式为________________________________________________
(3)该同学欲验证硫燃烧产物的性质,请你帮助他选择合适的试剂,并说明原因。
| A.新制的氯水 | B.品红溶液 | C.滴有酚酞的NaOH稀溶液 | D.H2S气体 |
| 性质 |
试剂 |
化学方程式 |
| 漂白性 |
||
| 氧化性 |
||
| 还原性 |
||
| 酸性氧化物 |