A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题: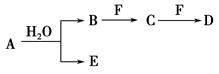
(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:______________________________________________。
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为________;D中所含化学键的类型为________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的式量相等,请用离子方程式表示F的水溶液呈酸性的原因:_______________________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的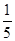 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
B转化为C的化学方程式为_______________________________________。
火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有。(填写字母编号)
| A.水体富营养化 | B.重金属污染 | C.雾霾 | D.酸雨 |
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式:
。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:A的化学式为,若生成ag A,理论上可以回收SO2的质量为g。
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式。
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
| 元素 |
相关信息 |
| W |
W的基态原子L层电子数是K层电子数的3倍 |
| X |
X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
| Y |
单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
| Z |
Z的基态原子外围电子排布式为(n-1)d10ns1 |
(1)Y位于元素周期表第________周期第________族;X的基态原子核外电子排布式是。
(2)W的简单离子半径X的简单离子半径(填“>”、“<”或“=”);Y的第一电离能比Z的(填“大”或“小”);W、X的最简单气态氢化物中,沸点较高的是(填化学式)。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,该反应的化学方程式为。
(4)W元素形成的多种化合物分子中,含有极性共价键和非极性共价键的分子名称为
(任写一种)。
(5)在25℃、101 kPa下,已知Z固体单质在Y2气体中完全燃烧后恢复至原状态,平均每转移1mol 电子放热110.05kJ,该反应的热化学方程式是。
已知少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出。现有A、B两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定两瓶溶液的成分及物质的量浓度,进行以下实验:
①取20mLA溶液,向其中缓慢滴入B溶液25mL,共收集到112mL(标准状况)气体。
②取25mLB溶液,向其中缓慢滴入A溶液20mL,共收集到56mL(标准状况)气体。
(1)写出少量盐酸与过量碳酸钠反应,无气体放出的离子方程式;
(2)为使上述①②反应完全,还需加入;(填“稀盐酸”或“碳酸钠溶液”)A溶液的物质的量浓度为 mol·L -1。
已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色。A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物。它们之间的转化关系如下图。反应②在工业上可用于制作印刷电路板。请回答下列问题:
(1)写出C和I的化学式:,;
(2)写出反应①的化学方程式:,写出反应②的离子方程式:;
(3)写出反应①在工业上的一种用途 。
某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
(1)镁铝合金中加NaOH溶液的离子反应方程式为,画出金属X的原子结构示意图,固体A的化学式为;
(2)写出硫酸铝在水中的电离方程式 ,操作②包含的步骤有蒸发浓缩、、过滤、干燥。
(3)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图装置,则需要测定的数据有 、。 