已知: (R、R’表示烃基或官能团)
(R、R’表示烃基或官能团)
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5 mol A完全燃烧只生成3 mol CO2和2.5 mol H2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六元环状酯类化合物。
请回答:
(1)1 mol B与足量的金属钠作用产生22.4 L(标准状况)H2。B中所含官能团的名称是 。
B与C的相对分子质量之差为4,B→C的化学方程式是 。
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是 、 。
(3)F可发生多种类型的反应。
①两分子F反应生成的六元环状酯类化合物的结构简式是 ;
②F可制得使Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是 ;
③F在一定条件下发生缩聚反应的化学方程式是 。
(4)A的结构简式是 。
A、B、C、D、E五种短周期元素的原子序数依次增大。元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E与元素B可形成具有正四面体结构的物质。请回答下列问题:
(1)在周期表中,元素B位于第周期第族;A与C形成的离子化合物的化学式为 _________________; A与C形成的离子化合物与水反应的化学方程式为。
(2)C形成的简单离子的离子结构示意图为。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式: ___________。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式: ______________________________________。
我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。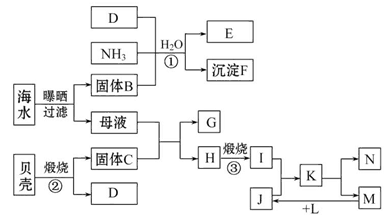
结合上述工艺流程回答下列问题:
(1)物质G和L的化学式分别为___________________和___________________。
(2)上述工艺流程中可以循环使用的物质的化学式为______________________。
(3)反应①的化学方程式为____________;在反应①中必须先通入NH3,而后通入D,其原因是_______________________________________________________。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为____________。
(5)由K溶液经如何处理才能制得N?_________________________________________________________。
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式____________________________。
②以下是对硝酸型酸雨的评价,其中正确的是_________________________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_______。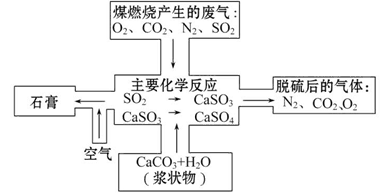
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)_______,它对环境的负面影响是____________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是_________________________。
某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银。步骤如下
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用________硝酸(填“浓”或“稀”)。原因是________ (填序号,下同)
a.减少过程中产生NOx的量
b.减少原料银的消耗量
c.节省硝酸的物质的量
(2)步骤B加热保温的作用是________。
a.有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中c(H+)
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是________。
a.置换反应
b.水解反应
c.氧化还原反应
产生的沉淀物化学式________。
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_________;若只能在加热情况下进行,则反应物A应为______________;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为________________________________________。