用8g NaOH固体配制成100mL NaOH溶液,并进行有关实验,计算并回答问题
(1)配成NaOH溶液的物质的量浓度是_____;
(2)配制溶液时需要的仪器应选择___________
① 100mL量筒 ②100mL烧杯③100mL容量瓶 ④胶头滴管 ⑤玻棒
(3)将所得溶液与一定质量的铝充分反应,铝全部反应完,生成的气体在标准状况下体积为3.36L。铝的质量______g。
有甲、乙、丙三种有机物,其结构简式如下:
已知A、B、C各代表—CH3、—CHO、—OH中的一种,甲、乙、丙互为同分异构体。
(1)将A、B、C代表的基团填在对应的表格内:
| A |
B |
C |
(2)甲、乙、丙按酸性由强至弱排列的顺序为________。
(3)有机物丙和新制的Cu(OH)2悬浊液共热反应的化学方程式为
______________________________________________
呋喃酚是合成农药的重要中间体,其合成路线如下:
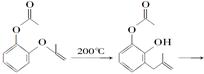

C D E(呋喃酚)
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________________,A在核磁共振氢谱中有____________组峰。
(2)B→C的反应类型是__________________________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式__________________。
(4)要鉴别化合物C和D,适宜的试是_________________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基
③含有酯基
写出下列物质转化的化学方程式,并指出反应类型
(1)溴乙烷 → 乙醇
(2)甲苯 → TNT
(3)乙醇→乙醛
(4)乙醛 +银氨溶液→
(5)氯乙烯→聚氯乙烯
芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1 mol H2,若l mol C与NaHCO3完全反应,也产生l mol气体,E可以使溴的四氯化碳溶液褪色。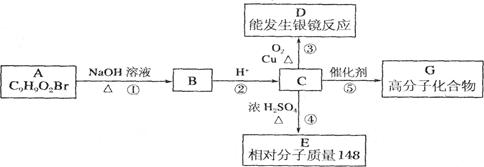
(1)D分子中的含氧官能团名称是___________,A的结构简式是___________。
(2)反应④的基本类型是_______反应,反应⑤的化学方程式是___________________________ 。
(3)与C取代基位置相同,既能与FeCl3溶液显色、又能发生水解反应的结构简式为: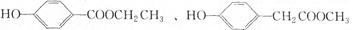 ,______________________、_____________________。(写两种即可)
,______________________、_____________________。(写两种即可)
植物精油具有抗菌消炎、解热镇痛等药物功用。从樟科植物枝叶中提取的精油中含有下列甲、乙、丙三种成分: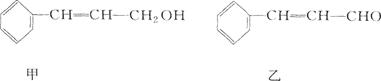
丙:分子式C16H14O2
(1)甲、乙中含氧官能团的名称分别为___________ 、___________。
(2)经下列过程甲可转化为乙: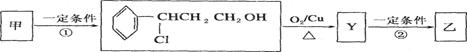
①,②的反应类型分别为___________、___________ 。
(3)通过下列合成路线由乙可得到丙(部分反应产物略去)
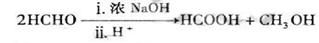
已知: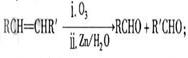
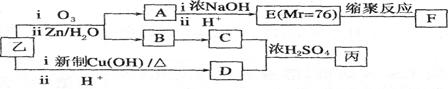
①F的结构简式为_________________________________。
②由乙制取D的化学方程式_______________________________________
③写出同时符合下列要求的D的同分异构体的结构简式______________________。
a.化合物是二取代苯
b,分子中有5种不同环境的氢原子,其个数比为1:2:2:1: 2
c.能使溴的CCl4溶液褪色,且在酸性条件下可以发生水解反应
④丙的结构简式为_________________。