某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度。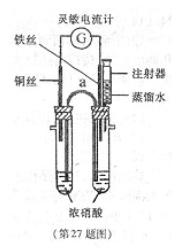
实验步骤如下:
①向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,
密度为1.4g/mL)。按图组装好实验装置。
②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1—2s)指向铁丝一端。
③用盛有5.0mL蒸馏水的注射器向具支试管内加水,并注视电流计的指针偏转方向。在指针恰好发生反转又指向铜丝时停止
实验,记录此时已注入的水的体积。
重复三次实验获得的数据如下:
| 实验次数 |
实验温度(℃) |
注入水的体积(mL) |
| 1 |
17.2 |
2.4 |
| 2 |
T1 |
2.5 |
| 3 |
T2 |
2.3 |
请回答下列问题:
(1)在该装置中仪器a因其作用而称为 ;指针指向铁丝时,铁丝为 极(填“正”或“负”)
(2)65%的硝酸的物质的量浓度是 ;在未注水前正极的电极反应式为 。
(3)T1 T2(填“>”、“<”或“=”)
(4)在本实验温度下,使铁钝化的硝酸最低浓度为 %;利用本实验数据判断,若以45%的硝酸进行实验(不再注水),则电流表的指针应指向 电极(填“铁”或“铜”)
(5)该实验装置上的不足是 ,改进方法是 。
将下列性质的番号,填入各小题后面对应的括号中:
| A.脱水性; | B.强酸性; | C.二元酸; | D.氧化性;(E)吸水性 |
(1)将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。()
(2)NaOH与H2SO4反应,可生成Na2SO4和NaHSO4这两种盐。()
(3)在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。()
(4)在稀HNO3中放入铝片就产生NO。()
(5)在稀H2SO4中放入铝片就产生H2。()
(6)在冷浓HNO3中放入铝片没明显现象。()
(7)浓H2SO4敞口久置会增重。()
(8)用稀硫酸清洗金属表面的氧化物()
在第3周期中,置换酸中氢的能力最强的元素的元素符号为,化学性质最稳定的元素符号是,最高价氧化物的水化物的酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为
、,原子半径最大的金属元素的名称是,离子半径最小的离子结构示意图是
有A、B、C、D、E五种元素,元素A的一种原子无中子,元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2,元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ar的电子层结构相同,试回答:
(1)它们的元素符号是:A________B________C________D________E________。
( 2)A和D的化合物与C和D的化合物(DC2)能否反应?若能反应写出反应方程式
下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑾ |
⑿ |
(1)写出下列元素的元素符号:① ② ⑾
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(4)在③与④的单质中,化学性质较活泼的是 ,判断依据是 ;在⑧与⑿的单质中,化学性质较为活泼的是 ,判断依据是
分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线: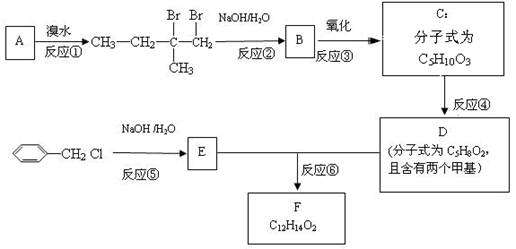
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现种峰;峰面积比为
(2)C物质的官能团名称
(3)上述合成路线中属于取代反应的是(填编号);
(4)写出反应④、⑤、⑥的化学方程式:
④
⑤
⑥
(5)F有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3;