石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
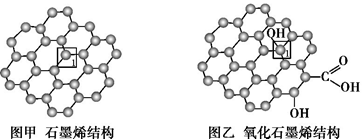
(1)图甲中,1号C与相邻C形成σ键的个数为 。
(2)图乙中,1号C的杂化方式是 ,该C与相邻C形成的键角 (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有 (填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一 种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为 ,该材料的化学式为 。
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂钯合金作催化剂),它的特点是使CO与NO反应,生成可参与大气生态循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式: _______________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是 _______________________。
(3)控制城市空气污染源的方法可以有 (多选算错)。
| A.开发氢能源 | B.使用电动车 | C.植树造林 | D.戴上呼吸面具 |
用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物组成是①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4中的 ,其物质的量之比为 。
(1)下列反应原理不符合工业冶炼金属实际情况的是( )。
A.2HgO 2Hg+O2↑ 2Hg+O2↑ |
B.Fe3O4+4CO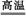 3Fe+4CO2 3Fe+4CO2 |
C.2MgO 2Mg+O2↑ 2Mg+O2↑ |
D.2Ag2O 4Ag+O2↑ 4Ag+O2↑ |
(2)简要说明不符合工业实际的原因: 。
有A、B、C、D四种元素,A和B两种元素的原子各有两个电子层;C、D两元素的原子各有三个电子层。A和B能化合生成无色无味的气体AB2,C和D能化合生成C2D,B和D是同族元素,B离子和C离子核外电子数相同。
(1)这四种元素分别是:A ,B ,C ,D 。
(2)用电子式表示C和D形成化合物的过程: 。
根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有 种,金属性最强的元素与氧气反应生成的化合物有 (填两种化合物的化学式)。
(2)属于稀有气体的是 (填元素符号,下同)。
(3)形成化合物种类最多的两种元素是 。
(4)第三周期中,原子半径最大的是(稀有气体除外) 。
(5)推测Si、N最简单氢化物的稳定性 大于 (填化学式)。