(一) 将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)
(3)原混合物中Na2CO3的质量分数为 。
(二).氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g) + 3H2(g) 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
⑴ 下列方法不适合实验室制取氨气的是 (填序号)。
A.向生石灰中滴入浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴入浓氢氧化钠溶液
⑵ 合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)。
A.采用较高压强(20 M Pa~50 M Pa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
(3) 用数字化信息系统DIS(如下图Ⅰ所示:它由传感器、数据采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.5000 mol/L醋酸溶液25.00 mL于烧杯中,以该种氨水进行滴定,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线如下图Ⅱ所示。

图Ⅰ 图Ⅱ
① 用滴定管盛氨水前,滴定管要用 润洗2~3遍,
② 试计算该种氨水的浓度: 。
③ 下列情况下,会导致实验结果c(NH3·H2O)偏低的是 。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,因不慎将氨水滴在烧杯外
(4) 1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H +),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。
+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。
正极的电极反应式为: 。
在 O2中燃烧 0.22 g 硫和铁组成的化合物,使其中的硫全部转化为 SO2,将这些 SO2全部转化为 SO3,生成的 SO3完全被 H2O 吸收。所得 H2SO4可用 10.0 mL 0.50 mol·L-1的 NaOH(aq)完全中和,则原化合物中硫元素的质量分数为_________。
实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同
学设计下列实验以确定上述混合气体中含有乙烯和SO2。
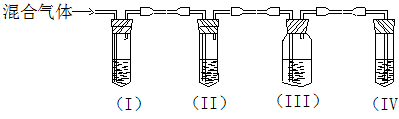 |
(1)I、II、III、IV装置可盛放的试剂是:I II III IV(请将下列有关试剂的序号填入空格内)
| A.品红 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是 ;
(1)使用装置II的目的是 ;
(2)使用装置III的目的是 ;
(3)确定含有乙烯的现象是 。
将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油.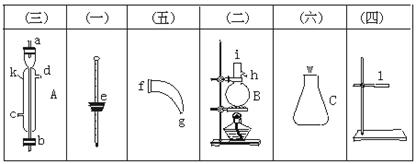
(1)图中A、B、C三种仪器的名称是___________.
(2)将以上仪器按(一) (六)顺序,用字母a,b,c…表示连接顺序:
(六)顺序,用字母a,b,c…表示连接顺序:
e接( )( )接( )( )( )接( )( )接( ).
(3)A仪器中c口是___________,d口是___________(填“进水口”或“出水口”)
(4)蒸馏时,温度计水银球应在___________位置.
(5)在B中注入原油后,加几片碎瓷片的目的是____________________________.
(6)给B加热,收集到沸点60℃~150℃间的馏分是___________,收集到150℃~300℃间的馏分是___________.
已知煤的近代结构模型如图所示:
(1)从煤的结构模型来看,煤是工业上获得___________烃的重要来源.
(2)我国大约70%的煤是直接用于燃烧的,从煤的结构模型来看,在提供热量的同时产生大量的___________等气体物质,造成严重的大气污染.
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%.“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐.下列物质中适宜于做固硫剂的是___________.
| A.氯化钙 | B.氧化钙 | C.硫酸钙 | D.氢氧化钙 |
(4)某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其“固硫”过程.
(5)除上述的“型煤”技术外,为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有___________,___________,___________等.
合成相对分子质量在2000~50000范围内具有确定结构的有机化合物是一个新的研究领域。1993年报道合成了两种烃A和B,其分子式分别为C1134H1146和C1398H1278。B的结构跟A相似,但分子中多了一些结构为 的结构单元。B分子比A分子多了个这样的结构单元(填写数字)。