已知:同一个碳原子上连有两个羟基时不稳定,会自动失水,即
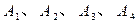 是化合物
是化合物 的四种同分异构体,它们的相对分子质量不超过l80.分子中只含碳、氢、氧三种元素,其中氧的质量分数为31.58%。实验表明:
的四种同分异构体,它们的相对分子质量不超过l80.分子中只含碳、氢、氧三种元素,其中氧的质量分数为31.58%。实验表明: 均是只有一个侧链的芳香族化合物,它们均含有醇羟基,并可以进行如下反应,产物中
均是只有一个侧链的芳香族化合物,它们均含有醇羟基,并可以进行如下反应,产物中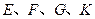 均为芳香族化合物。
均为芳香族化合物。
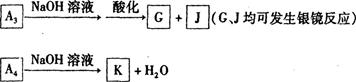
(1) 的相对分子质量为 ,分子式为 。
的相对分子质量为 ,分子式为 。
(2)写出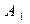 、
、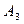 的结构简式。
的结构简式。 ;
; 。
。
(3)写出由 生成
生成 的化学反应方程式 ,该反应的反应类型为 。
的化学反应方程式 ,该反应的反应类型为 。
(4)A4除羟基外的含氧官能团的名称为_________ 。
根据下面的反应路线及所给信息填空。
(1)A的结构简式是_____________,名称是_____________。
(2)②的反应类型_____________,③的反应类型_____________。
(3)反应④的化学方程式 。
苹果酸是一种常见的有机酸,其结构简式为:
(1)苹果酸含有的官能团名称是__________、__________,在一定条件下,苹果酸可发生化学反应的类型有 (填序号)。
a.水解反应 b.缩聚反应 c.加聚反应 d.中和反应
(2)写出苹果酸与足量金属钠发生反应的化学方程式:__________________________。
(3)1mol苹果酸与足量碳酸钠充分反应生成的气体在标准状况下体积为__________。
下列有机化合物中,有的有多个官能团:
(1)可以看作醇类的是(填入编号,下同) 。
(2)可以看作酚类的是 。
(3)可以看作羧酸类的是 。
(4)可以看作酯类的是 。
氮及其化合物之间可以互相转化,请按照要求回答下列问题:
(1)实验室制取氨气。
① 实验室制取氨气的反应原理是利用了 类物质与 类物质的反应。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中, 会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:氨的催化氧化:____________。
② 体现N元素的氧化性:____________。
①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是 (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是 。
(2)写出HCl的电离方程式 。
(3)写出过氧化钠与水反应的化学方程式___________________________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________。
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式_______________________。