据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4将来可用作更强有力的火箭推进的氧化剂 |
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的: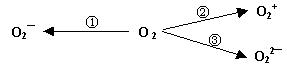
上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:__________________。
某兴趣小组利用如图所示装置进行实验。
(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是;阳极电极反应式为。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体mL
(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上(填“能”或“不能”)恢复原样。
发射卫星时可用肼(N2H4)为燃料和二氧化氮(NO2)作氧化剂,两者反应生成氮气和气态
水。已知:
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1①
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-543 kJ·mol-1② H2(g)+
H2(g)+ F2(g)===HF(g)ΔH=-269 kJ·mol-1③
F2(g)===HF(g)ΔH=-269 kJ·mol-1③
H2(g)+ O2(g)===H2O(g) ΔH=-242 kJ·mol-1④
O2(g)===H2O(g) ΔH=-242 kJ·mol-1④
(1)肼和二氧化氮反应的热化学方程式为______________________________________
(2)有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大,试写出肼和氟气反应的热化学方程式:____________________________________________________
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是______________,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为________________;若四种离子的关系符合④,则溶质为__________________。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。

若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。
已知:
| 酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
| CH3COOH |
1.8×10-5 |
HCN |
5×10-10 |
| H2CO3 |
Ka1=" " 4.2×10-7 |
HClO |
3×10-8 |
| Ka2=" " 5.6×10-11 |
(1)用方程式表示HCN溶液显酸性的原因:______________________________。
(2)上述四种酸中,酸性最强的是;
(3)25℃时,0.01 mol/L NaCN溶液的pH________7;
(4)在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为;
(5)向pH=4的CH3COOH溶液中,加入下列物质,能使CH3COOH电离平衡向逆向移动的是:_________________。
①加入少量NH4Cl固体②加入等体积pH=5的盐酸
③加入少量Na2CO3固体④加入等体积0.01 mol/L的CH3COONa 溶液
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是________(填“强酸”或“弱酸”)。
(2)②组情况表明c_____0.2(填“大于”、“小于”或“等于”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是____________________。
(3)分析第③组实验结果,说明HA的电离程度________NaA的水解程度(填“大于”或“小于”)。该混合溶液中离子浓度由大到小的顺序是____________________________。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
(5)写出①组混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)=________mol·L-1;
c(OH-)-c(HA)=________mol·L-1。