(5分)五种短周期元素A、B、C、D、E,A原子的最外层电子数是次外层的3倍;B是第三周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物,且B、D的原子核外电子层数相同;C和D能形成CD3的化合物;C原子比E原子多1个电子;1.8 g C与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24 L;C原子中质子数比中子数少1。则:
(1)元素A在周期表中的位置 。
(2)D与E形成的化合物的电子式 。
(3)A、B、D简单离子的半径大小关系 。(用离子符号表示)
(4)C单质溶于B的最高价氧化物的水化物的离子方程式 。
下图所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: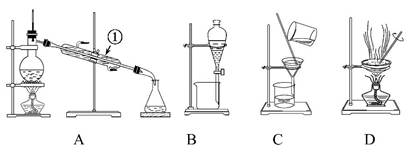
(1)从氯化钾溶液中得到氯化钾固体选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是 。装置B在分液时为使液体顺利滴下,应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
海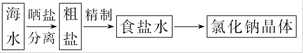
问题1:粗盐中含Ca2+、Mg2+、Fe3+、S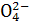 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 (填写序号字母)。
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 (填写序号字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:按所选顺序操作时,步骤④的化学方程式是
。
问题3:由海水到氯化钠晶体的实验过程中要用到的主要装置是 (从给定的四种装置中选择)。
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。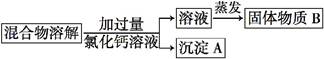
(1)沉淀A的化学式是 。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作是 。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分
为 (用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为 。
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= 。
回答下列与氯有关的问题。
(1)自来水可以用氯气消毒。
①某学生用这种自来水配制下列物质的溶液,不会产生明显的药品变质的是 。
A.硝酸银 B.氢氧化钠
C.碳酸钠 D.氯化铝
②自来水厂常使用氯气消毒,市场上有些小商小贩用自来水充当纯净水出售。下列试剂中,可用来辨其真伪的是 。
A.酚酞试液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
③用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是
(用化学方程式表示)。
(2)写出下列反应的化学方程式。
氯气与铁反应: ;
氯气与氢氧化钠反应: 。
氢元素有1H、D、T三种原子,对于分别由它们形成的三种单质:
(1)在标准状况下,三种单质的密度之比是 。
(2)1 mol各种单质中,它们的质子数之比是 。
(3)1 g各种单质中它们的中子数之比是 。
(4)在标准状况下,1 L它们的单质中,它们的电子数之比是 。