某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
| 实验步骤 |
向3—4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
| 实验现象 |
产生白色沉淀 |
| 离子方程式 |
(1) |
| 小组讨论交流 |
向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象 |
| 假设出现的实验现象,说明理由 |
假设:Ⅰ无现象 理由:反应没有限度,Ca2+沉淀完全 假设:Ⅱ(2) ,理由:(3) |
| 证明你的假设 |
现象:产生大量的白色沉淀 |
| 离子方程式 |
(4) |
| 解释 |
(5) |
下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)所需浓H2SO4的体积为__________(用下一小题的仪器量取)。
(2)如果实验室有15mL、20mL、50mL量筒,应选用_______mL量筒最好。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌。
(4)将的上述溶液沿玻璃棒注入___________中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀。
(5)加水至距刻度线1-2cm时,改用加水,使溶液凹液面跟刻度相平。
(6)用“偏高”“偏低”或“无影响”填空:
① 定容时,观察液面俯视:;
② 摇匀后,液面低于刻度线,没有再加水:;
③ 取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理:。
分析下图装置,回答问题:
(1)装置A的烧瓶中发生的反应的化学方程式为,
(2)装置C的直玻管中发生的反应的化学方程式为,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是,
(4)装置E中NaOH的作用是,反应的离子方程式为;
(5)B装置的作用很多,除了可以混匀气体外,
还可以:____________________; __________________________________。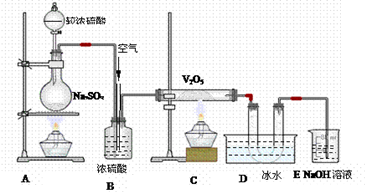
某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。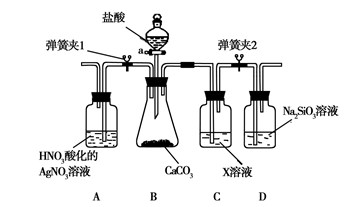
实验操作步骤:
Ⅰ. 打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ. A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是______。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________,
D中反应的化学方程式是________。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。
某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制FeS04溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴人几滴浓HN 03,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色突然变为蓝色,并产生红棕色气体。这一奇 特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04·7H2 0)置于烧杯中,__________________________。
(2)提出假设:
甲同学认为是FeS04与HN03作用
乙同学认为是KSCN与HNO3作用
(3)根据乙同学的观点,设计了如下实验方案进行验证:向浓HN03中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体。继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通人过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一);向反应后的溶液中加入BaC12溶液产生白色沉淀。
写出向浓HNO3中滴入KSCN溶液反应的离子方程式:__________________
丙同学认为还应设计K2S04溶液与浓硝酸作用的实验,他的理由是__________________
(4)延伸探究:丁同学认为SCN-的性质还应进一步探究,查资料发现:(SCN)2是一种“拟卤素”,与C12、Br2有相似的性质。他据此设计了以下方案:向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色。请写出Fe(SCN)3与氯气反应的离子方程式:。
(5)通过本次探究,可以得出以下结论:
a、用SCN -间接检验Fe2+时加入氧化剂应注意(填“少量”、“过量”);
b、与SCN-反应使溶液变红的不一定是Fe3+
某化学学习小组欲探究己烷的性质,用己烷进行下利实验:
实验1:
实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
实验3:根据下图的实验装置进行己烷催化裂化
请回答下列问题:
(1)实验1中用到的玻璃仪器有(填名称);
(2)由实验1知己烷的物理性质有 ;
(3)实验2中的橙色溶液逐渐变浅的原因是 ;
| A.己烷与溴发生发生取代反应 | B.溴代己烷为无色物质 |
| C.液溴向外挥发浓度降低 | D.己烷与液溴发生加成反应 |
E.液溴与己烷分层,密度大的液溴在下层
(4)实验3的装置Ⅱ的作用是;
(5)试管C中看到的现象是,说明有生成;
(6)试写出装置Ⅰ中发生有丙烷生成的裂化反应方程式:
。