某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。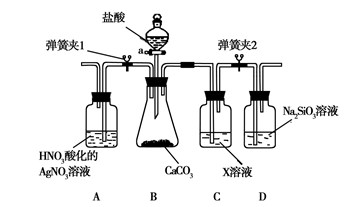
实验操作步骤:
Ⅰ. 打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ. A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是__ ____。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是______ __,
D中反应的化学方程式是_____ ___。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。
(9分)A、B、C是中学常见的三种非金属单质,常温下B为无色气体,A、C为固体,甲、乙、丙为中学常见的三种化合物,常温下C易溶于乙中,A、B、C与甲、乙、丙之间的转化关系如下图所示:
(1)写出C转化为丙的化学方程式________________________________________。
(2)常温下,按右图装配装置,待内外气体压强不变时,水银柱液面在M处,取下橡皮塞,在玻璃燃烧匙中加入乙,乙在B中充分燃烧,水银柱推向左管。
简要回答下列问题:
①写出乙燃烧的化学方程式:_____________________________________________。
②水银柱推向左管的原因是______________________________________________。
③火焰熄灭后,静置一段时间恢复到原温度,右管水银的位置应该是________。
A.仍在M处 B.高于M处 C.低于M处
做出选择后,简要说明理由_______________________________________________。
④用下图所示装置检验乙燃烧的产物A、B、C、D中所盛放的药品名称是:
A.________ B.________ C.________ D.________
(9分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)SO2气体还原Fe3+的产物是________、________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是____。
(2)下列实验方案适用于在实验室制取所需SO2的是________(填序号)。
A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是____________________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、________、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是____________________________________。
(6)能表明I-的还原性弱于SO2的现象是____________________________________。
(1)用过量铜片与0.2 mol浓H2SO4共热足够长时间(只考虑铜与浓H2SO4反应,忽略其他副反应),甲认为产生的SO2少于0.1 mol,理由是________________________________________________________________________
________________________________________________________________________;
而乙同学认为产生的SO2为0.1 mol,理由是_____________________________________________。
(2)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为___________________________________________________________。
利用铜制备CuSO4的另一种方法可用化学方程式表示为_________________________________________。
以上两种方法________(填“前”或“后”)者好,原因是_____________________。
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。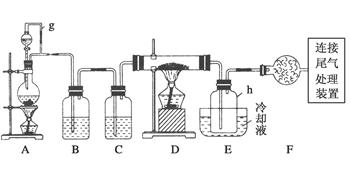
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
| 升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________________。
(2)装置A中g管的作用是________;装置C中的试剂是________;装置E中的h瓶需要冷却的理由是__________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(9分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):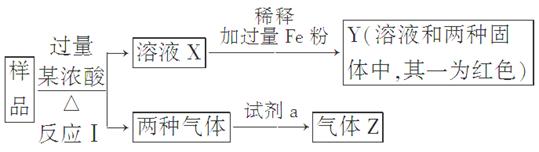
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是____________________________________________________________
________________________________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)________。