(1)用过量铜片与0.2 mol浓H2SO4共热足够长时间(只考虑铜与浓H2SO4反应,忽略其他副反应),甲认为产生的SO2少于0.1 mol,理由是________________________________________________________________________
________________________________________________________________________;
而乙同学认为产生的SO2为0.1 mol,理由是_____________________________________________。
(2)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为___________________________________________________________。
利用铜制备CuSO4的另一种方法可用化学方程式表示为_________________________________________。
以上两种方法________(填“前”或“后”)者好,原因是_____________________。
I.(1)某同学做如下实验,以检验反应中的能量变化。
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。其中(用序号填空):能设计成原电池的反应是_________。
II.(1)有下列几种物质
A.金刚石和石墨
B.C2H6和C5H12
C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2
E.35Cl和37Cl
属于同分异构体的是_____;属于同素异形体的是_____;属于同系物的是_____;属于同位素的是______。
(2)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是( )
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
III.(1)C7H16名称
(2)指出下列反应的类型:乙烯使酸性高锰酸钾溶液褪色:
(3)写出反应的化学方程式:三氯甲烷与氯气在光照下反应
(14分)某学生欲配制6.0 mol·L-1的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______ mol·L-1(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______ mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol·L-1的浓硫酸____ mL,沿玻璃棒倒入上述混合液中,并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1 cm~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?______(填“偏大”“偏小”或“无影响”)。
(5)进行操作C前还需注意__________________________________。
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。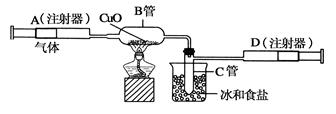
在注射器A中装有240毫升气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32克,实验后B管重20.00克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩尔X气体的体积是24000毫升,则X的摩尔质量是________克/摩尔。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)__________________。
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。
已知乙醛在加热条件下能与新制Cu(OH)2反应生成Cu2O。
回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为(填仪器接口的字母编号)(加热和夹持装置已略去).
(2)B装置中发生的化学方程式.
(3)F装置中的固体试剂是,发生反应的化学方程式为.
反应一断时间后移去酒精灯,反应能继续进行,其原因是.
(4)A装置和D装置中的实验现象分别为.
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见.
实验室中用甲醇、水、空气和铜粉制取甲醛溶液。下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生置不同,分别如甲和乙所示。请回答下列问题: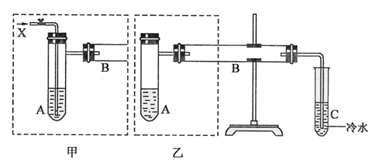
(1)在仪器组装完成后,加装试剂前必须要进行的操作是;
(2)若按甲装置进行实验,则通入A的X是,B中发生反应的化学方程式为;
(3)若按乙装置进行实验,则B管中应装入的物质是,B中发生反应的化学方程式为;
(4)两套装置中都需要加热的仪器有(选填A、B、C);
(5)设计实验,检验实验后C中所得液体确为甲醛溶液:。