I.(1)某同学做如下实验,以检验反应中的能量变化。

实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。其中(用序号填空):能设计成原电池的反应是_________。
II.(1)有下列几种物质
A.金刚石和石墨
B.C2H6和C5H12
C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2
E.35Cl和37Cl
属于同分异构体的是_____;属于同素异形体的是_____;属于同系物的是_____;属于同位素的是______。
(2)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是( )
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
III.(1)C7H16名称
(2)指出下列反应的类型:乙烯使酸性高锰酸钾溶液褪色:
(3)写出反应的化学方程式:三氯甲烷与氯气在光照下反应
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):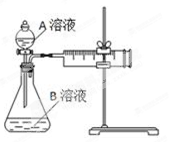
| 实验序号 |
A溶液 |
B溶液 |
| ① |
20 mL 0.1 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
| ② |
20 mL 0.2 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
(1) 该实验探究的是因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是①②(填“>”、“<”或“=”)。
(2) 若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=_______mol·L-1。(假设混合溶液体积为50 mL)
(3) 除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定来比较化学反应速率。
(4) 小组同学发现反应速率总是如下图,其中t1~t2时间内速率变快的主要原因可能是: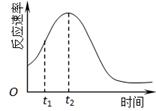
①产物Mn2+是反应的催化剂、②。
(12分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
| 实验步骤 |
预期现象与结论 |
|
| 步骤1 |
取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的,振荡溶解,过滤后将滤液配成250mL溶液,待用。 |
|
| 步骤2 |
取少量步骤1中滤液于试管中, |
|
| 步骤3 |
取少量步骤1中滤液于试管中, |
步骤1中加入足量1mol/L CuSO4溶液的作用是。
.苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白: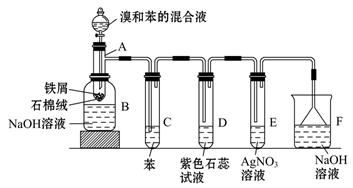
(1)试管C中苯的作用是:_____________________________________。
反应开始后,观察D和E两试管,看到的现象为: D ______________; E__________________________。
(2)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是________________________________。
(3)在上述整套装置中,具有防倒吸的仪器有______________________________(填字母)。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1) MgCO3的分解产物为。
(2) 装置C的作用是,处理尾气的方法为。
(3) 将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯给装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
已知:3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色)
① 乙组得到的黑色粉末是;
② 甲组步骤1中反应的离子方程式为;
③ 乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为
;
④ 从实验安全考虑,上图装置还可采取的改进措施是;
实验室需要配制0.55mol·L-1 NaOH溶液220 mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1) 选择仪器。完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、_____________、__________________ 。
(2) 计算。配制该溶液需取NaOH晶体________g。
(3) 称量。
① 天平调平后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
② 称量过程中NaOH晶体应放于天平的__________(填“左盘”或“右盘”)。
(4) 溶解、冷却,该步实验中需要使用玻璃棒,目的是______________________________。
(5) 转移、洗涤。在转移时应使用玻璃棒引流,应注意______
;需要洗涤烧杯2~3次是为了________________________________________________________________________。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明溶液名称、浓度及配制的时间。
(8)下列操作使所配溶液浓度偏大的有______________(填字母,下同);偏小的有_____________;
无影响的有_____________。
A 称量时用生锈的砝码 B 将NaOH放在纸上称量
C NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 D 往容量瓶转移时有少量液体溅出
E、未洗涤溶解NaOH的烧杯F、定容时仰视刻度线
G、容量瓶未干燥就用来配制溶液