下列电离方程式正确的是
A.H2S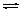 2H+ + S2- 2H+ + S2- |
B.HClO = H+ +ClO- |
C.CH3COONH4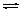 NH4+ +CH3COO- NH4+ +CH3COO- |
D.H2CO3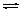 H+ + HCO3- H+ + HCO3- |
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
| A |
B |
C |
D |
|
| 强电解质 |
Fe |
NaCl |
CaCO3 |
HNO3 |
| 弱电解质 |
CH3COOH |
NH3 |
H3PO4 |
Fe(OH)3 |
| 非电解质 |
C12H22O11(蔗糖) |
BaSO4 |
C2H5OH |
H2O |
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ(恒容)和Ⅱ(恒压)中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量与时间的变化关系如图所示,则下列有关推断正确的是( )
A.该反应的化学方程式:3X+2Y 3Z 3Z |
| B.若两容器中均达到平衡后,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t0 |
| C.若两容器中均达到平衡后,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D.达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应 |
已知可逆反应:X(s)+aY(g) bZ(g);ΔH,反应达到平衡时,温度、压强对可逆反应的影响如右图所示(图中p为压强,其中p1>p2)。下列有关判断正确的是( )
bZ(g);ΔH,反应达到平衡时,温度、压强对可逆反应的影响如右图所示(图中p为压强,其中p1>p2)。下列有关判断正确的是( )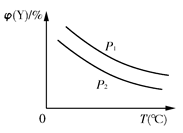
| A.可逆反应的焓变ΔH<0 |
| B.反应的化学计量数a<b |
C.该可逆反应的平衡常数K=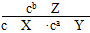 |
| D.温度、压强不变,若使用合适的催化剂,可以提高Y的转化率 |
T°C时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。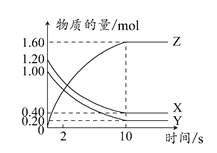
下列描述正确的是 ( )
| A.平衡时,X、Y的转化率相同 |
| B.达到平衡后,将容器体积压缩为1 L,平衡向正反应方向移动 |
C.T°C时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数K=40 2Z(g),平衡常数K=40 |
| D.T°C时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率约为60% |
一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )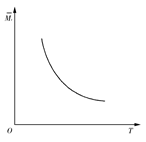
| A.温度升高,平衡常数K减小 |
| B.化学计量数a为1 |
| C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2 |
| D.X的转化率α=Q1/Q |