已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20%KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
| 沉淀物 |
开始沉淀时的pH |
沉淀完全时的pH |
| Mg(OH)2 |
9.6 |
11.1 |
| Fe(OH)3 |
2.7 |
3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| …… |
|
现有短周期元素X形成的单质A与NaOH溶液反应,
有如下 转化关系:
转化关系: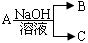 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为,实验室制备A的化学方程式为;
(2)若常温常压下,A为非金属固态单质 ,且其在电子工业中有着重要的用途,则工业制取A化学方程式为;
,且其在电子工业中有着重要的用途,则工业制取A化学方程式为;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
;其最高氧化物与NaOH溶液反应的离子方程式为;
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下: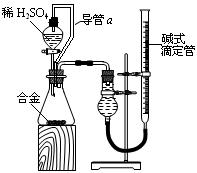
①装置中导管a的作用是 ;
;
②实验中准确测得4个数据:实验前该合金的质量m1 g,实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL;则通常状况时气体摩尔体积Vm=____________L·moL-1。
由A、B、C、D四种金属按下表中装置进行实验。
| 装置 |
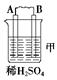 |
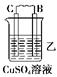 |
 |
| 现象 |
二价金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是___________________________________________ __。
__。
(2)装置乙中正极的电极反应式是_____________________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是_________________________________________。
下图装置Ⅰ是实验室制乙酸乙酯的常用装置: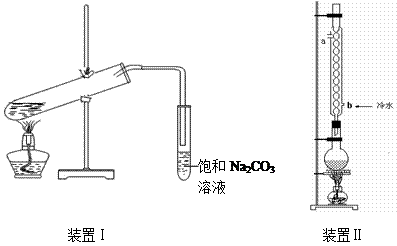
(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
||
| 乙醇 |
-114 |
78 |
0.789 |
||
| 乙酸 |
16.6 |
117.9 |
1.05 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
||
| 98%H2SO4 |
10 |
338 |
1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置) ,浓H2SO4的作用是 。
(2)要 从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振
从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振 荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。
实验室制取乙酸乙酯的主要步 骤如下:
骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)配制该混合溶液的主要操作步骤为:__ _____________________________________;反应中浓硫酸的作
_____________________________________;反应中浓硫酸的作 用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器 ________(填:“下口放” 或“上口倒 ”)出。
”)出。
(11分)某同学用下图所示装置制取乙烯,请回答: 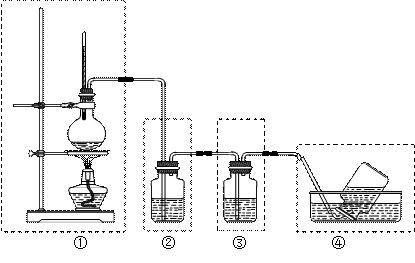
(1)在装置①~③中,有明显错误的一个装置是_____(填序号),改进方法是
。
(2)实验室制取乙烯的化学方程式为,反应类型为。
(3)配制乙醇和浓硫酸混合液的方法是。
(4)若装置②中所盛试剂为氢氧化钠溶液,则其作为。
(5)若装置③中的试剂为溴的四氯化碳溶液,观察到的现象是。
(6)实验前往往在烧瓶中加入一些碎瓷片,目的是_________________________。