已知25℃时,有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法不正确的是
| A.25℃时,0.1mol/L的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| C.25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则 c(Na+)—c(CH3COO-)=9.9×10-7mol/L |
| D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH+)+c(HCO-3)+2c(CO2-3) |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③若有0.5mol电子流经导线,则可产生5.6LH2
④SO 向Zn极移动
向Zn极移动
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu-2e-====Cu2+,
发生氧化反应则卡片上的描述合理的是
| A.②④ | B.②③ | C.③④ | D.④⑥ |
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的质子数是Y的核外电子数的一半,Y与M可形成化合物M2Y,下列说法正确的是
| A.Z元素的最高价氧化物的水化物的化学式为HZO4 |
| B.离子半径:M的离子>Z的离子>Y的离子>X的离子 |
| C.X、M两元素形成的化合物只有M2X、M2X2两种 |
| D.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
| A.Y的单质能将X从NaX的溶液中置换出来 |
| B.X的氢化物的沸点比Y的氢化物的沸点低 |
| C.X与H2化合放出的能量比Y与H2化合放出的能量少 |
| D.X的气态氢化物比Y的气态氢化物稳定 |
下列装置或操作能达到实验目的的是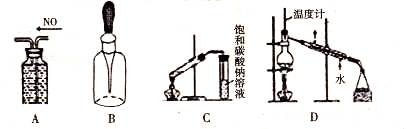
| A.排水集气法收集NO |
| B.用滴瓶长期保存NaOH溶液 |
| C.实验室制取乙酸乙酯 |
| D.石油的分馏 |
下列化学用语表示正确的是
| A.乙烯的结构简式:CH2CH2 |
B.四氯化碳的电子式: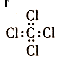 |
C.CO2的比例模型: |
| D.HClO的结构式:H—O—Cl |