(1 5分)
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满状态,且核外的未成对电子只有一个。回答下列问题:
(1)X能形成多种常见单质,在熔点最低的单质中,每个分子周围紧邻的分子数为 ;在熔点最高的两种单质中,X的杂化方式分别为 、 。
(2)X、Y分别与H形成的化学键的极性关系为X—H Y —H,键能关系为
—H,键能关系为
X—H __Y—H(填“<” 、“>”或“=”)。
、“>”或“=”)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第 电离能。
(4)短周期元素中有一种元素与Z元素位于不同周期的相邻主族,且性质与Z十分相似,由该元素形成的单质属于  晶体。
晶体。
(5)W的价电子排布图为 ;W的基态原子有 种形状不同的原子轨道,W基态原子有 种形状不同的原子轨道;W单质中W原子的配位数为 ;下图 表示的是W晶体中微粒的堆积方式(填甲、乙或丙);工业冶炼W的单质有两种常见方法,写出火法炼W的化学方程式 。
(6)向W的硫酸盐溶液中逐滴滴加氨水至过量,最终形成的化合物中含 、 键(填化学键类型,任写两种即可)。
483g Na2SO4·10H2O中所含的Na+的物质的量是和SO42—的物质的量是,所含H2O分子的数目是个。
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是,被氧化的元素是,氧化剂是,还原剂是,氧化产物是,还原产物是。
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH2K2CO3+6H2O 
(1)请回答图中甲、乙两池的名称。甲电池是装置,乙池是装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式:通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标况下)。
A、B、C、D均为含苯环的化合物,且分子量B>A>C,已知有机物A的结构简式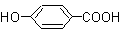
⑴写出A和NaHCO3溶液反应的化学方程式:__________________________________________
⑵有机物B在浓H2SO4存在下,相互作用生成一种环状酯,如下图。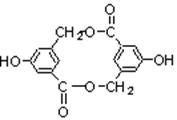
则有机物B的结构简式为___________________,1mol B最多能与_________ mol H2发生加成反应。
⑶ D和B互为同分异构体,且苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na、NaOH反应,等质量的D消耗Na、NaOH的物质的量之比为2∶3,则D的结构简式有_____种,写出其中一种物质的结构简式___________________。
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH溶液,其正极反应为,负极反应为;
(2)若电解质溶液为硫酸,其正极反应为,负极反应为;
若反应过程中转移了2mol电子,可产生水的质量为g。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)
=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。此时氢氧燃料电池外电路中转移电子数为,消耗H2的质量为。