下图所示装置中,甲、乙、丙三个烧杯依次分别盛有100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
⑴接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中C电极质量增加。据此回答问题:
①电源的N断为__________极;
②电极b上发生的电极反应为________________________________________;
③电极b上生产的气体在标准状况下的体积为____________L;
④电极c质量变化是______________g ;
⑤ 电解前后各溶液的酸碱性大小是否发生变化,简述其原因:
电解前后各溶液的酸碱性大小是否发生变化,简述其原因:
甲溶液:______________________________________; 乙溶液:______________________________________;
乙溶液:______________________________________;
丙溶液:______________________________________;
⑵如果电极过程中铜全部析出,此时电极能否继续进行,为什么?
已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤1的主要操作 是,需用到的玻璃仪器除烧杯外有
是,需用到的玻璃仪器除烧杯外有 。
。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式),
固体残渣的成分是(填化学式)
 。
。
(3)步骤3中涉及的操作是:蒸发浓缩、、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 
。
(10分)某溶液中含有Ba2+、Cu2+、Ag+三种离子。现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右所示(写出最佳答案)
(1)沉淀的化学式:沉淀1,沉淀2 ,沉淀3;
,沉淀3; (2)写出混合液+A的离子方程式:。
(2)写出混合液+A的离子方程式:。
溶液+B的离子方程式:。
(12分)饮用水消毒的主要目的是杀灭可引起霍乱、伤寒、痢疾等疾病的病菌,含氯消毒剂由于杀菌力 强,价格低等优点,一直是当今世界上应用最广泛的一种杀菌剂,为人类的健康立下了汗马功劳。回答下面各小题。
强,价格低等优点,一直是当今世界上应用最广泛的一种杀菌剂,为人类的健康立下了汗马功劳。回答下面各小题。
(1)氯气是一种色、具有刺激性气味、(填“无”或“有”)毒的气体。
(2)在水灾后,卫生防 疫部门向广大居民发放了漂粉精,用于饮用水的杀菌消毒,漂粉精的有效成分是。
疫部门向广大居民发放了漂粉精,用于饮用水的杀菌消毒,漂粉精的有效成分是。
(3)用化学方程式表示工业生产漂粉精的反应原理。
(4)已知H2CO3的酸性比HClO强,若把漂粉精暴露在空气中,请你推测会发生什么反应,写出反应的化学方程式,根据这一特性,漂粉精的保存方法为。
A能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。
① Ni原子的价电子排布式是__________。
② 该合金储氢后,含1mol La的合金可吸附H2的
物质的量为____________________。
(2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶 水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是____________________。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是__________。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8 电子稳定结构。
电子稳定结构。
该阴离子的电子式是__________,其中心原子N的杂化方式是__________。
草酸亚铁用作分析试剂及显影剂等,其制备流程如下: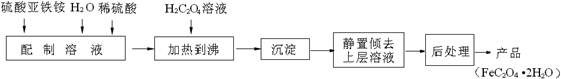
(1)配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是________________________________________________________。
6H2O溶液时,需加少量稀硫酸,目的是________________________________________________________。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图10(TG%表示残留固体质量占原样品总质量的百分数)。
①A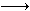 B发生反应的化学方程式为
B发生反应的化学方程式为
__________________________________________。
C处时残留物的化学式为______________。
②有研究学者在实验过程中用气相色谱还检出
H2,最终产物中也有微量的磁性物质生成,_____________________________
请你猜想用一个方程式解释这种事实:______________________________ 。
③ 现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g) Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?____________________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?____________________________。