已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态。(答题时用ABCDE对应的元素符号表示)
(1)A的氢化物A2H2分子的空间构型为__________,其中心原子采取的杂化形式为___________,分子中含有___________个 键,__________π键。
键,__________π键。
(2)写出化合物DC的电子式_______,E原子的核外电子排布式________。
(3)由E元素形成的金属的晶胞结构如右图,则该晶胞中含有金属原子的数目为_______________。
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于__________(填晶体类型)。
将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(s)+dD,当反应进行一定时间
cC(s)+dD,当反应进行一定时间 后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
(1)该化学方程式各物质的化学计量数为a=_____、b=______、c=_____、d=______。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质D的聚集状态为______。
(3)若只升高温度, 反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
设反应①Fe(s)+CO2(g) FeO(s)+CO(g) △H = Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) △H = Q1的平衡常数为K1,反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H = Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H = Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度( T ) |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g)△H = Q
CO(g)+H2O(g)△H = Q
①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应 。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积B.降低温度 C.使用合适的催化剂
D.设法减 少CO的量E.升高温度
少CO的量E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3 =_____________;
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)。设计如下对比实验。
(1)请完成以下 实验设计表(请填满表中空缺地方,表中不要留空格)。
实验设计表(请填满表中空缺地方,表中不要留空格)。
| 实验编号 |
实验目的 |
T/K |
pH |
 c/10-3mol·L-1 c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验做参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
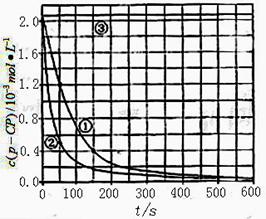
【数据处理】实验测得p-CP的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50 -150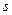 内的反应速率ν(p-CP )=
内的反应速率ν(p-CP )=
【解释与结论】
(3)实验①②表明温度升高,降解反应速率增大。但 温度过高时反而导致降解反应速率减小,请从Fenton法所使用试剂H2O2的角度分析原因:;
温度过高时反而导致降解反应速率减小,请从Fenton法所使用试剂H2O2的角度分析原因:;
(4)实验③得出的结论是:pH=10时,;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来,根据上图中信息,给出一种迅速停止反应的方法: 。
。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度分别为c(A)=0.100mol/L,c(B)=0.200mol/L,c(C)=0.000mol/L。反应物A浓度随时间变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度分别为c(A)=0.100mol/L,c(B)=0.200mol/L,c(C)=0.000mol/L。反应物A浓度随时间变化如图所示。
请回答下列问题:
(1)实验③平衡时C的浓度为____________;
(2)与①比较,②和③分别仅改变一种反应条件。其中,②所改变的条件___________,
判断的理由是:__________________________________;③所改变的条件是_________。
(3)该反应的△H _____0,判断其理由是___________________________________________。
(4)下图表示实验 ①条件下达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。若降温时,请把反应速度变化情况画在图中a~b处。
①条件下达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。若降温时,请把反应速度变化情况画在图中a~b处。
利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示。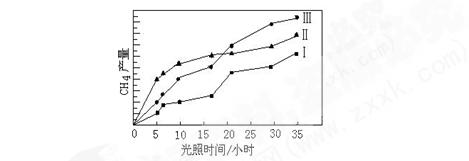
(1)在0-15小时内,CH4的平均生成速率vⅠ、vⅡ和v Ⅲ 从大到小的顺序为 ;
反应开始后的30小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)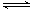 CO(g)+3H2(g),该反应的△H="+206" kJ•mol-1
CO(g)+3H2(g),该反应的△H="+206" kJ•mol-1
①在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)
②将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结 果保留两位有效数字)。
果保留两位有效数字)。
(3)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= -890kJ·mol-1,现有甲烷和一氧化碳的混合气体共0.75mol,完全燃烧后生成气态二氧化碳和18g液态水,并放出515kJ热量,请写出一氧化碳燃烧的热化学方程式__________________ 。