下列有关化学用语正确的是
A.某元素原子的轨道排布式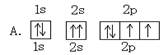 |
B.NH3电子式为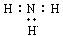 |
| C.Ca2+离子基态电子排布式为1s22s22p63s23p6 |
D.钾(K)原子的原子结构示意图为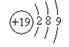 |
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
| A.自来水可以用氯气杀菌消毒,因为氯气具有强氧化性、漂白性 | |
| B.加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
C.工业上用热还原法冶炼太阳能电池板中的硅 |
D.随意丢弃废旧电池,会导致水体和土壤重金属污染 |
用下图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量。下列叙述不正确的是()
| A.E表示反应生成Cu的物质的量 |
| B.E表示反应消耗H2O的物质的量 |
| C.F表示反应生成H2SO4的物质的量 |
| D.F表示反应生成O2的物质的量 |
下列A~D四组,每组有两个反应,其中两个反应不能用同一个离子方程式表示的是( )
| (Ⅰ) |
(Ⅱ) |
|
| A |
少量SO2通入Ba(OH)2溶液 |
SO2通入过量Ba(OH)2溶液 |
| B |
少量浓氨水滴入Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
| C |
0.1 mol Cl2通入含0.2 mol FeBr2的溶液中 |
0.3 mol Cl2通入含0.2 mol FeBr2的溶液中 |
| D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
用NA表示阿伏加德罗常数。下列叙述正确的是
| A.1.0L0.1mol/L的NH4Cl溶液中NH4+的个数为0.1NA |
| B.常温下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数为0.1NA |
| C.常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1NA |
| D.高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。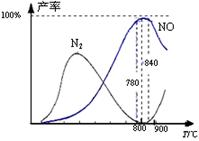
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是
| A.工业上氨催化氧化生成 NO时,温度应控制在 780~840℃之间 |
| B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率 |
| C.加压可提高NH3生成NO的转化率 |
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) △H=-181.5 kJ·mol-1 2NO(g) △H=-181.5 kJ·mol-1 |