请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有______(填元素符号),
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2 分子的键角是__________。
分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如 [Co(H2O)6]2+显粉红色。其中Co2+的价电子排布式为________________________
[Co(H2O)6]2+显粉红色。其中Co2+的价电子排布式为________________________
(4)利用CO可以合成化工原料COCl2,其中
①COCl2分子的结构式为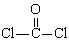 ,②COCl2分子内含有 (填标号);
,②COCl2分子内含有 (填标号);
A.4个σ键 B.2个σ键、2个π键
C.2个σ键、1个π键 D.3个σ键、1个π键
从某些植物树叶提取的挥发油中含有下列主要成分: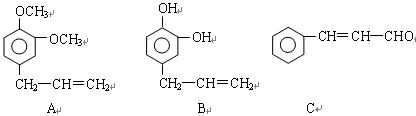
(1)有关A、B、C三种物质的说法正确的是(填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为。
(3)0.5molB与足量的溴水充分反应,消耗mol单质溴。
(4)已知: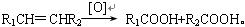 有机物C9H8O发生如下反应:
有机物C9H8O发生如下反应: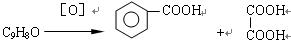
则C9H8O的结构简式为。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
在新型锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用G表示)的结构简式如下:
G的合成方法如下:
请回答下列问题:
(1)反应①、⑤的反应类型分别为_______,________。
(2)A的结构简式___________。
(3)写出含有-OH和-COOH的D的同分异构体任意2种:
_________________________,_______________________________。
(4)写出B→C反应方程式________________________________________。
(5)写出E→F反应方程式________________________________________。
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式________。
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是_______(填序号)。
| A.烷烃 | B.烯烃 | C.炔烃 | D.苯的同系物 |
② 适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)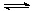 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。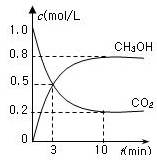
从反应开始到平衡,v(H2)=______;氢气的转化率=_______;能使平衡体系中n(CH3OH)增大的措施有______。
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(l)ΔH2=-285.8 kJ/mol
H2O(l)ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
| 溶解度(S)/g |
溶度积(Ksp) |
||
| Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
| 0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是_________[填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定__________。
已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。
在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;
反应中还原剂是_________;被还原的元素是_________。
(2)写出b点到c点反应的离子方程式___________。
(3)当溶液中的I-为0.4 mol时,加入的KIO3为_____________mol 。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为
____________________________________________________。
(1)银锌电池广泛用做各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。工作时原电池的总反应是:Ag2O + Zn + H2O ="==" 2Ag + Zn(OH)2,根据上述变化判断:①原电池的正极是__________。②工作时原电池两极反应式为:
负极,正极
(2)用铜电极电解NaOH溶液,写出
①阳极的电极反应_____________________________________
②电解总反应_______________________________________