对可逆反应aA(g)+bB(g) cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: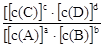 =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g) CO2(g)+H2(g)+Q。在850℃时,K=1。
CO2(g)+H2(g)+Q。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
(7分)A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图 ,E元素在周期表中的位置是 。
(2)A与C形成的化合物中,原子个数比为1:1的化合物的结构式为 。
(3)D与C按原子个数比为1:1形成化合物的电子式是 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 、 (填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的一种化合物反应的离子方程式: 。
(6分)现有0.1 mol·L-1的Na2SO4和0.1 mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
(1)当加入50 mLBa(OH)2溶液时,所得溶液中的溶质是,其物质的量浓度为mol·L-1。
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为mL,所得溶液中溶质为,则该溶质物质的量浓度为mol·L-1
工业合成氨的反应N2+3H2= 2NH3的能量变化如下图所示,请回答有关问题: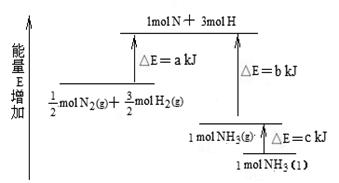
(1)合成 1 mol NH3(l) ____________(填“吸收”、“放出”)_____________kJ的热量。
(2)已知:拆开lmol H—H 键、lmol N-H 键、lmol N≡N 键分别需要的能量是436kJ、391kJ、946kJ。则上图中的 a=___________kJ;1 mol N2(g) 完全反应生成NH3(g)产生的能量变化为 ______KJ。
(3)推测反应 2NH3(l)= 2N2 (g)+3H2(g) 比反应2NH3(g)= 2N2 (g)+3H2(g)_____________(填“吸收”、“放出”)的热量____________(填“多”、“少”)。
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请回答下列问题:
(1)Y 元素的名称______________;
(2)W 在元素周期表中的位置是第____________周期第____________族;
(3)X2M2中存在的化学键有___________、____________;
(4)Z、W氢化物的稳定性顺序为__________________;
已知:某原电池的总反应为:2Fe3++Cu===2Fe2++Cu2 +。则:
(1)该原电池的负极材料为_______________,该电极上所发生的反应是___________________;
(2)该原电池的正极材料可为______________,该电极上所发生的反应是___________________
(3)若负极质量减少 1.28 克,那么电路中转移的电子数为___________________。