(17分)氮及其化合物在工业生产和科技等领域有广泛应用。
(1)肼(N2H4)常用于火箭或原电池的燃料。已知:(i)N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol
(ii)N2H4(g)+ O2(g)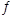 N2(g)+2H2O(g) ΔH=-534kJ/mol
N2(g)+2H2O(g) ΔH=-534kJ/mol
(iii)H2O(g)= H2O(1) ΔH=-44kJ/mol
①反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) ΔH =_______kJ·mol-1
②一定温度下,将N2H4与NO2以体积比1:1置于10 L密闭容器中发生反应2N2H4(g)+ 2NO2(g)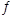 3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4与NO2体积比保持不变 d.体系压强保持不变
③在10 L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
前2min内NO2的平均反应速率为___________。平衡时NO2的转化率________;该温度下反应的平衡常数K=_________。
反应在第6min时改变了条件,改变的条件可能是__________。(填序号)
a.使用催化剂 b.升高温度 c.减小压强 d.增加NO2的量
(2)HNO3和As2S3能发生反应:As2S3+10HNO3==2H3AsO4+3S+10NO2↑+2H2O,反应中被氧化的元素为_________。
若该反应中转移电子的物质的量为5 mol时,产物中的S经过转化全部生成浓H2SO4,然后与足量的铜在加热条件下反应消耗铜的量_________。(填序号)
a.小于0.75 mol b.等于0.75mol c.大于0.75mol d.无法确定
氯气和氮氧化物都是重要的化工原料,但进入大气后,都对环境造成污染。
【Ⅰ】已知:2KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+ 8 H2O,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。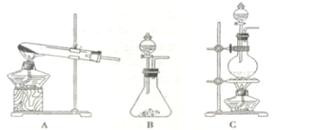
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是。(选填A或B或C)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式:。
(3)常用NaOH溶液吸收氯气防止污染。写出该反应的离子方程式。
【Ⅱ】已知:NO2+NO+2NaOH=2NaNO2+H2O,可用氢氧化钠溶液可以吸收废气中的氮氧化物。
(1)在该反应中,氧化剂是。
(2)汽车尾气中含有一氧化氮和一氧化碳,经过排气管中的催化转化器转化为对大气无污染的物质。写出该反应的化学方程式:。
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3 kJ。写出该反应的热化学方程式。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别
通入乙烷和氧气。通入乙烷气体的电极应为极(填写“正”“负”)该电极上发生的电极反应
式是
(3)如图所示实验装置中,石墨棒上的电极反应式为;如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 __________(填物质名称)。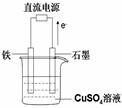
A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示: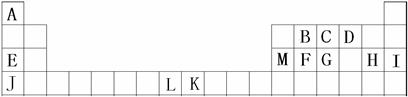
(1)B、C、D三种元素的第一电离能由大到小的顺序为(用元素符号表示);
(2)有下列物质①CA3②GA3③EH④JH⑤FD2。请将这些物质的熔点由高到低排列(填这些物质的序号),其中CA3、GA3在常温、常压下都是气体,但CA3比GA3易液化,其主要原因是。
(3)2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净L(可用于合成氨反应的催化剂)的表面上存在C原子,右图为C原子在L的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表L原子)。则在图示状况下,L颗粒表面上L/C原子数之比为。
(4)A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如图),由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中二种环境的N原子的杂化形式分别是。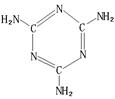
(5)M单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示。 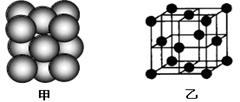
请回答:晶胞中M原子的堆积方式为,配位数为。
I.下列分子中,属于非极性分子的是
| A.SO2 | B.BeCl2 | C.BBr3 | D.COCl2 |
II. 铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)Cu+基态核外电子排布式为_______________。
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为:_________________;
CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______________________;
(3)SO42-的立体构型是__________,其中S原子的杂化轨道类型是____;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,粒子之间的作用力是__________;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为(列式并计算)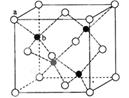
人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
(1)羟基磷酸钙中钙元素的质量分数________(保留到0、1g)
(2)包装标签上脂肪≥3.3g,是指100ml牛奶中含脂肪至少3.3g。那么一盒牛奶中含钙至少_____g。(保留到0.01g)
计算过程: