I.下列分子中,属于非极性分子的是
| A.SO2 | B.BeCl2 | C.BBr3 | D.COCl2 |
II. 铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)Cu+基态核外电子排布式为 _______________ 。
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为:______________ ___;
CuSO4粉末常用来检验一些有机物中的微量水分,其原因是______________________ _;
(3)SO42-的立体构型是__________,其中S原子的杂化轨道类型是____ ;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,粒子之间的作用力是__________;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算)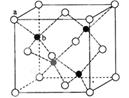
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 |
性质 |
| A |
一种核素的原子核内不含中子 |
| B |
原子核外电子有6种不同运动状态 |
| C |
最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D |
单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E |
在地壳中的含量位居第三 |
| F |
周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G |
该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
根据以上信息,回答下列问题:
(1)画出元素C的基态原子核外电子排布图:____;D、E、F三种元素的第一电离能大小顺序为:____(用元素符号表示)。
(2)FD2中F原子的杂化类型为______;分子空间构型为______;FD2易溶于水的原因可能是:_____(填入序号)。①FD2与水极性相同②FD2可以与水反应
(3)由B元素形成的某种单质作电极,插入碱液中构成BA2D2的燃料电池,则该电池的负极电极反应式为 。
(4)化合物BA2D2蒸气293 K时,理论测算密度为1.9 g·L-1,实际密度为2.5 g·L-1的原因是___。
(5)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:______。
(6)化合物M在碱性条件可用于制备一种“绿色”环保高效净水剂K2FeO4(高铁酸钾)。补充完整并配平该制备反应的化学方程式:□____+□KNO3+□____=□K2FeO4+□KNO2+□H2O
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
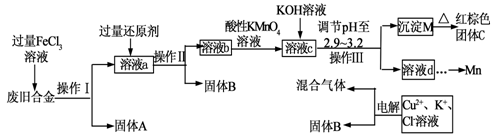
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2] =1.9×10-13。
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是。
(2)过量的还原剂应是。
(3)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为g(用含X、Y的代数式表示)。
(4)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:﹥﹥。(填金属阳离子)
(5)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为L(用含Z的代数式表示);阳极产生的最后一种气体的反应式为。
X、Y、Z、W、Q、R均为前4周期元素,且原子序数依次增大。其相关信息如表所示:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y原子的2p轨道中有3个未成对电子 |
| Z元素的族序数是其周期数的3倍 |
| W原子的第一至第四电离能分别为: I1=578 kJ·mol-1I2=1 817 kJ·mol-1I3=2 745 kJ·mol-1 I4=11 575 kJ·mol-1 |
| Q为前4周期中电负性最小的元素 |
| 元素R位于周期表的第11列 |
请回答下列问题:
(1)Y3-的原子结构示意图为___________________,Y的氢化物的空间构型为______________。
快速制备Y的氢化物可用Y的氢化物的浓溶液与NaOH固体的原因_________________。
(2)已知YZ2+与XZ2互为等电子体,写出YZ2+的电子式____________________。
(3)R的基态原子价电子排布式为______________________,R的氯化物的水溶液与Q单质发生反应的离子方程式为____________________________________________________。
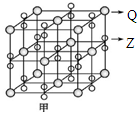
(4)化合物甲由Z、Q两种元素组成,其晶胞如图,甲的化学式为
________________。
(5)已知由X形成的自然界硬度最大的单质完全燃烧的燃烧热
为395 kJ/mol。且1 mol Z=Z键完全断裂时吸收热量497 kJ,1 mol
X=Z键形成时放出热量745 kJ,则单质X中1 mol X—X键断裂时吸收热量为___________________。
(16分)实验室需要80mL 2mol/L碳酸钠溶液。回答下列有关配制该溶液的问题(实验室中没有80mL规格的容量瓶):
(1)所需要的仪器为:托盘天平、量筒、烧杯、玻璃棒、_________、_________。
(2)配制该溶液需要Na2CO3的质量为_________g。
(3)配制溶液的操作顺序是(填序号)_________。
①转移溶液;②轻摇使溶液混合均匀; ③洗涤并转移洗涤液;④加盖倒转摇匀溶液; ⑤定容; ⑥称量⑦溶解;⑧计算
(4)正式配制前必须进行的一项实验操作是__________________。
(5)试分析下列操作对所配溶液的浓度有何影响:(填写编号)
A.偏高;B.不变;C.偏低。
①配制溶液时未洗涤烧杯并转移洗涤液_________;
②定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线_________;
③定容时俯视刻度线_________。
一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物
填空和回答下列问题
(1)B物质是(写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,此杂质的化学式为,因为上述方案中某一步设计有毛病,这一步的正确设计方案应是。
(3)写出生成沉淀B的离子方程式
(4)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是