D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,D、E的最简单氢化物分子的空间结构依次是正四面体、三角锥型,X原子的最外层电子数是次外层电子数的一半,Y元素的最高正价和最低负价的代数和为4,Z元素的原子是所处周期中原子半径最小的。回答下列问题:
(1)D和Z形成的化合物的结构式是_________;D和Y形成的分子的名称是_ ___。
(2)Y和Z的简单离子的半径大小为__________(用离子符号和“>”、“=”或“<”表示)。
(3)比较元素非金属性的强弱有很多方法,关于D和X的非金属性强弱的研究方案中不可行的是_________(填序号)。
①比较氢化物的稳定性 ②依据两元素在周期表的位置 ③比较两种单质的颜色
④比较单质与H2化合的难易程度 ⑤比较最高价氧化物对应水化物的酸性
(4)当满足一定比例时,Z的单质可与E的最简单氢化物反应生成一种盐和另一种单质,试写出该反应的化学方程式________________________。
(5)写出下列反应的化学方程式:
①工业上用D的单质制X的单质___________________________________;
②E的最高价含氧酸的浓溶液与单质D反应__________________________。
(6)E有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则生成的E的含氧酸盐的化学式是__________。
依据事实,写出下列反应的热化学反应方程式。
(1)在25℃、101kPa下,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为 。
(2)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为 。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为_________________________________________________。
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
按要求填空。
I.下列各组中的两种有机物,可能是:(A)相同的物质,(B)同系物,(C)同分异构体。请判断它们之间的关系(用A、B、C填空)
①2-甲基丁烷和丁烷 ,②正戊烷和2,2-二甲基丙烷_________,
③对二甲苯和1,4—二甲苯___________,④1-已烯和环已烷_______________。
II.按官能团的不同,可以对有机物进行分类,将符合要求的答案填在横线上。
①CH3CH2CH2COOH②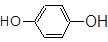 ③
③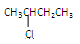
④ ⑤
⑤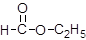 ⑥
⑥
(1)芳香烃: ;(2)卤代烃: ;(3)酚: ;
(4)醛: ;(5)羧酸: ;(6)酯: 。
(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO3-)变化趋势可能是:
①逐渐减小;
②逐渐增大;
③先逐渐增大,而后减小;
④先逐渐减小,而后增大。
4种趋势中可能的是________。
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快B.H2SO4最快 C.CH3COOH最快D.一样快
(3)某温度下,纯水中c(H+)=2×10-7mol/L,则此时c(OH-)=________mol/L。相同条件下,测得:①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是 。
(4)已知:酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合液中,各种离子浓度关系正确的是________
A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B.c(HCO3-)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+c(CO32-)
(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):______ ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
已知2A2(g) + B2(g) 2C(g)
2C(g) 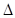 H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
(1)a b(填“>”“=”或“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达到平衡后,吸收热量c kJ,C的浓度 w mol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:
(用等式表示)。
(4)能说明该反应已经达到平衡的状态的是 。
a.ν(C)=2ν(B2) b.容器内压强保持不变
c.ν(A2) (逆) =ν(B2) (正)d.容器内的密度保持不变