(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的: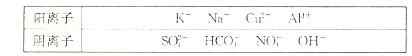
为了鉴别上述化合物。分别完成以下实验,其结果是:
①、将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②、将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③、进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④、在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体, C、D中产生
C、D中产生 白色沉淀;
白色沉淀;
⑤、 将B、D两溶液混合,未见沉淀或气体生成.
将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)、写出B、D的化学式:B (2分),D (2分)。
(2)、将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 (2分)。
(3)、在A溶液中加少入量澄清石灰水,其离子方程式为 (2分)。
(4)、C常用作净水剂,用离子方程式表示其净水原理 (2分)。
如下图,甲、乙、丙分别表示在不同条件下可逆反应:
A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
请根据图象回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况,则曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是热反应(填“吸”或“放”),计量数x的值(填取值范围);判断的依据分别是 。
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装稀硫酸,B槽中盛装CuSO4溶液。通电一段时间后,发现d电极上覆盖一层红色物质。
根据以上实验事实,回答下列问题:
(1)c极的电极反应式为 ;
(2)A槽中发生反应的化学方程式为;
(3)A槽中溶液的pH(填“变大”、“变小”或“不变”)。
(4)B槽中溶液的pH(填“变大”、“变小”或“不变”)。
在25℃时,对于0. 1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中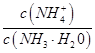 将(填“增大”、 “减小”或“不变”);
将(填“增大”、 “减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH 7(填“大于”、“小于”或“等于”),用离子方程式表示其原因,此时溶液中各离子浓度由大到小的顺序为.
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式为
若二元酸H2SO4的电离方程式是:H2SO4=H++HSO4-,HSO4- SO42-+H+。回答下列问题:
SO42-+H+。回答下列问题:
(1)Na2SO4溶液显性,理由是(用离子方程式表示);
(2)NaHSO4溶液显性”,理由是(用离子方程式表示);
(3)若0.1mol·L-1NaHSO4溶液的pH=2,则0.1mol·L-1H2SO4溶液中氢离子的物质的量浓度可能0.11mol·L-1(填“<”、“>”或“=”=:理由是;
(4)0.1mol·L-1NaHSO4溶液中各离子浓度由大到小的顺序是。
现代生活离不开铝,工业上以铝土矿为原料生产铝。现将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500mL溶液。取100mL该溶液,测得其中含 有H+、Cl―、Mg2+、Al3+、Fe3+ 五种离子(不考虑其它离子)。已知部分离子的物质的量浓度为:
c(H+)= 0.02mol·L―1 c(Mg2+)= 0.01mol·L―1
c(Fe3+)= 0.02mol·L―1c(Cl―)= 0.52mol·L―1
(1)溶液中Al3+ 物质的量浓度为mol·L―1
(2)则该铝土矿样品中Al2O3的质量为g。(精确至0.01 g)