现代生活离不开铝,工业上以铝土矿为原料生产铝。现将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500 mL溶液。取100 mL该溶液,测得其中含 有H+、Cl―、Mg2+、Al3+、Fe3+ 五种离子(不考虑其它离子)。已知部分离子的物质的量浓度为:
c(H+) = 0.02 mol·L―1 c(Mg2+)= 0.01 mol·L―1
c(Fe3+)= 0.02 mol·L―1 c(Cl―) = 0.52 mol·L―1
(1)溶液中Al3+ 物质的量浓度为 mol·L―1
(2)则该铝土矿样品中Al2O3的质量为 g。(精确至0.01 g)
已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。
请填写下列空白
(1)写出化学式:D,K。
(2)写出②的离子方程式。
(3)反应④不属于下列何种反应类型(填字母序号)。
A. 化合反应 B. 氧化还原反应 C. 离子反应 D. 置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为(填序号)。
A. KSCN溶液和氯水 B. 铁粉和KSCN
C. 浓氨水 D. 酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式。
FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是(填字母序号)。
| A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可。 |
| B.在FeCl3溶液中加入足量的NaOH溶液 |
| C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体 |
| D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀 |
证明此胶体已经制成的最简单方法为。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:
2FeCl3+ 2KI = 2FeCl2+ I2+2KI
在上式上用双线桥法标出该反应电子转移的方向和数目。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为色,再将混合液倒入(填仪器名称)中,将两层液体分离。
在①浓H2SO4②稀H2SO4③浓HNO3④稀盐酸⑤NaOH溶液⑥氨水 ⑦双氧水 ⑧氯气 ⑨铁粉 ⑩铜粉中选择最佳试剂,除去下列物质中所含有的少量杂质(括号内是杂质,填序号)。
(1)Fe2O3(SiO2)。(2)Na2CO3溶液(NaHCO3)。
(3)FeCl3溶液(FeCl2)。 (4)铁粉(铝粉)。
铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO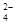
 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1) 该蓄电池放电工作时的负极材料是,用其电解氯化钠溶液,当阳极上收集到11.2L氯气时(标况下),理论上负极板的质量增加g。
充电时,上图中A极应接直流电源的(填“正极”或“负极”)。充电时A极的电极反应式是;
(2) MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式 。现以铅蓄电池为电源电解,当蓄电池中有0.4mol H+被消耗时,则电路中通过的电子的物质的量为,MnO2的理论产量为 g。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
(1) M为直流电源的________极,b电极上发生的电极反应为_____________。
(2) 计算e电极上生成的气体在标准状况下的体积为________________。
(3) 写出乙烧杯中的总反应的离子方程式:______________________________。
(4) 要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)。