硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①:  。
。
猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
| |
实验操作 |
实验现象或预期实验现象 |
现象解释 (用离子方程式表示) |
| 猜想② |
(1) |
溶液pH=8 |
——— |
向pH=2的 硫酸中滴加Na2S2O3溶液 硫酸中滴加Na2S2O3溶液 |
(2) |
S2O32—+2H+=S↓+SO2↑+H2O |
|
| 猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
(3) |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由 。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 。
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO (g) + 2H2 (g)  CH3OH (g)△H=-116kJ/mol
CH3OH (g)△H=-116kJ/mol
(1)该反应的化学平衡常数表达式为;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是(填字母序号) 。
a.随时将CH3OH与反应混合物分离b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3)一定条件下,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是(填字母序号).
a.c ( H2 )减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c ( H2 )/ c (CH3OH )减小
(4)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P)的关系如图所示。
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tAtC(填于“大于”、“小于”或“等于”)。
②若A点时容器的体积为1 L,该温度下B点的平衡常数K= 。
现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H0(填“>”或“<”),且m1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率,B的转化率。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色,
若维持容器内压强不变,充入氖气时,混合物颜色(填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。
则0~2 min内的平均反应速率υ(C)=。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: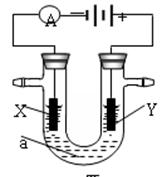
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。
在X极附近观察到的实验现象是。
②Y电极上的电极反应式为。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是,电极反应式为。
②Y电极的材料是,电极反应式为。(说明:杂质发生的电极反应不必写出)
电解一段时间后,CuSO4溶液的浓度将(填“变大”、“变小”或“不变”)
(1)下图是工业氮气和氢气合成1mol氨气过程中能量变化示意图,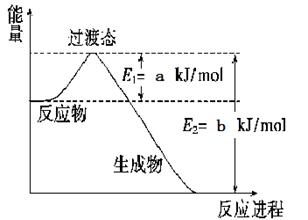
请写出该反应的热化学方程式。
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=C02(g)△H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=____。
(3)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如下图所示。
正极上发生的电极反应为___
阴极上发生的电极反应为___
(4)如图是甲烷燃料电池原理示意图,回答下列问题: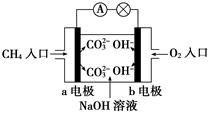
①电池的负极是________(填“a”或“b”)极,负极的电极反应式是___。
②电池工作一段时间后电解质溶液的pH______(填“增大”、“减小”或“不变”)
苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH= CH2)的反应方程式为:
C6H5-CH2CH3 (g) C6H5-CH=CH2 (g) +H2(g)ΔH1=+125kJ•mol﹣1
C6H5-CH=CH2 (g) +H2(g)ΔH1=+125kJ•mol﹣1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示: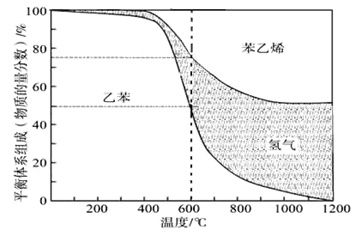
600℃时,由上图可知:
①氢气的物质的量分数为。
②此温度下该反应的平衡常数。
(2)分析上述平衡体系组成与温度的关系图:
当温度高于970℃,苯乙烯的产率不再增加,其原因可能是。
(3)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。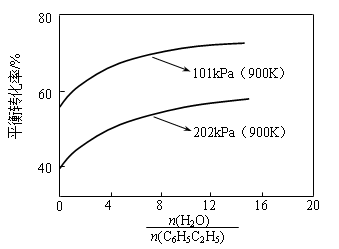
加入稀释剂能影响C6H5C2H5平衡转化率的原因是:______________________________。
(4)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因______________________________________________。
(5)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率30%
(6)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3 (g)+ 1/2O2(g) C6H5-CH=CH2 (g) +H2 O (g) ΔH
C6H5-CH=CH2 (g) +H2 O (g) ΔH
已知 H2的燃烧热ΔH为-285.8KJ/mol,水的汽化热为2441.12焦耳/克,则 ΔH=。