如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象: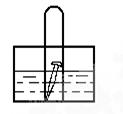
(1)若试管内液面上升,则溶液呈_____________性,电极反应式为:正极:______________
(2)若试管内液面下降,则溶液呈_______ ___性,,正极电极反应式为:_______
下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其它产物均已略去)。
填写下列空白:
(1)物质B是,F是,J是。
(2)反应①的离子方程式是
抽烟对人体有害。烟草不完全燃烧产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生如下反应:CO+Hb·O2 O2 + Hb·CO,实验表明,Hb·CO的浓度即使只有Hb·O2的2℅,也足以使人的智力受损。试回答:(1)上述反应的平衡常数表达式为:K=_________________。(2)抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6mol /L和10-2mol /L。已知37℃时,平衡常数K=220,这时Hb·CO的浓度________(填“大于”、“小于”或“等于”) Hb·O2浓度的0.02倍。
O2 + Hb·CO,实验表明,Hb·CO的浓度即使只有Hb·O2的2℅,也足以使人的智力受损。试回答:(1)上述反应的平衡常数表达式为:K=_________________。(2)抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6mol /L和10-2mol /L。已知37℃时,平衡常数K=220,这时Hb·CO的浓度________(填“大于”、“小于”或“等于”) Hb·O2浓度的0.02倍。
在1.00 L 1.00 mol·L-1 NaOH溶液中通入16.8 L标准状况下的CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量分别为________。
最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料回答下列问题:
(1)铷37Rb位于周期表的第________周期、第________族。
(2)关于铷的结构和性质判断正确的是________。
①与水反应比钠剧烈②它的原子半径比纳小③它的氧化物暴露在空气中易吸收CO2④它的阳离子最外层电子数和镁相同⑤它是还原剂
A.①③④ B.②③⑤ C.②④ D.①③⑤
(3)氢化铷与水反应可放出氢气,则下列叙述正确的是________。
A.氢化铷溶于水显酸性
B.氢化铷中氢离子被还原为氢气
C.氢化铷与水反应时,水是还原剂
D.氢化铷中氢离子最外层有两个电子
(4)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________。
A.Li B.Na C.K D.Cs
铁路提速为鲜活水产品、新鲜水果和蔬菜的运输提供了有利条件。
在鲜活鱼的长途运输中,必须考虑以下几点:水中需要保持适量的O2;及时除去鱼排出的CO2;防止细菌的大量繁殖。现有两种在水中能起供氧灭菌作用的物质,其性能如下:
过氧化钠(Na2O2):易溶于水,与水反应生成NaOH和O2;
过氧化钙(CaO2):微溶于水,与水反应生成Ca(OH)2(微溶)和O2。
根据以上介绍,你认为运输鲜活水产品时应选择 加入水中。原因是 。
在不通风场所,苹果会散发 的气味,时间久了会腐烂;马铃薯块茎通过
呼吸产生乳酸。铁路提速可减少鲜果和蔬菜在运输中的损耗。