下列离子方程式书写正确的是
| A.碳酸钙溶于过量的乙酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| B.氟气与水反应:F2+H2O===H++F-+HFO |
| C.溴化亚铁溶液中通人少量氯气:2Fe2++C12=2Fe3++2Cl- |
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O 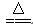 Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
下列电离方程式正确的是
| A.CaCl2=Ca2++Cl2‑ |
| B.Na2SO4=Na+ +SO42- |
| C.HNO3=H++NO3- |
| D.NaHCO3=Na++ H+ + CO32- |
某同学在实验报告中记录下列数据,其中正确的是
| A.用25mL量筒量取12.36mL盐酸 |
| B.用托盘天平称量8.75g食盐 |
| C.用500mL的容量瓶配制450mL溶液 |
| D.用广泛pH试纸测得某溶液的pH为3.5 |
下列实验操作正确的是
| A.闻气体气味 | B.加热水 | C.倾倒液体 | D.移走蒸发皿 |
汞(熔点-39℃,沸点356℃)是制造电池、电极的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。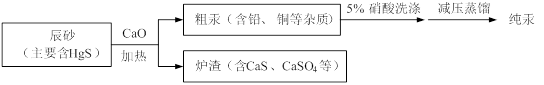
下列分析错误的是
| A.洗涤粗汞可用5%的盐酸代替5%的硝酸 |
| B.辰砂与氧化钙加热反应时,CaSO4为氧化产物 |
C.“灼烧辰砂法”过程中电子转移的方向和数目可表示为: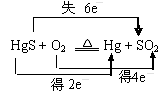 |
| D.减压蒸馏的目的是降低汞的沸点,提高分离效率 |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| 物质 组别 |
甲 |
乙 |
丙 |
| A |
Cl2 |
MgBr2 |
NaOH |
| B |
SO2 |
Ca(OH)2 |
NaHCO3 |
| C |
SiO2 |
NaOH |
HF |
| D |
NH3 |
O2 |
HNO3 |