物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)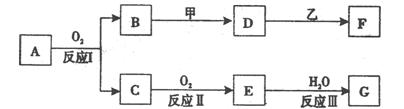
回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:①反应Ⅲ的化学方程式为_______________________ ____________。
②D与乙反应的离子方程式为___________________________ _________
(2)第二种情况:甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________
生产设备名称为:
②D和乙反应的离子方程式为____________________________________
③请简述检验D溶液中阳离子的方法 。
④若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数= (列出计算式即可)。
在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应N2O4(g) 2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算a =,此温度时该反应的平衡常数K=;
(2)改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号)。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
根据条件推测下列有机物名称,其中A、B为不饱和烃,C为高分子化合物。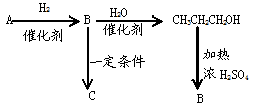
(1)写出各物质结构简式AB
(2)写出下列转化反应方程式及反应类型
B→C,
CH3CH2 CH2OH→B的方程式,
A和溴水(足量)的化学方程式,
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为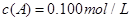 、
、 及
及 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的 Q_____0,判断其理由是________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: =____________________;
=____________________;
短周期元素中,某些不同族元素的单质及其化合物有相似的化学性质,如铍和铝都能与氢氧化钠溶液反应;下图是元素周期表的一部分,编号为③的元素最外层与最内层电子数等
(1)编号为⑤的元素的符号为,其在周期表中位于。
(2)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:。
(3)己知AlCl3的熔点为190 ℃(2.5×105Pa),沸点为182.7℃,
试推测:
①BeCl2是化合物(填“离子”或“共价”),
②Be(OH)2的碱性比LiOH 。
(4)根据Mg在空气中的燃烧情况, Li在空气中燃烧生成的产物为 __(用化学式表示)。
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______;
(2)写出该反应的化学方程式,并标出电子转移的方向和数目:____ ___ ;若反应中生成0.2 mol HNO3,转移的电子数目为______个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是____________;一旦NF3泄漏,可以用溶液(填化学式)喷淋的方法减少污染。