下列对于硝酸的认识,不正确的是
| A.浓硝酸和稀硝酸都具有氧化性 | B.铜与硝酸的反应属于置换反应 |
C.浓硝酸在常温下见光或受热会 分解 分解 |
D.常温下可用铁或铝制品盛装浓硝酸 |
已知:A(g)+B(g)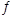 C(g)+D(g)
C(g)+D(g)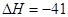 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下: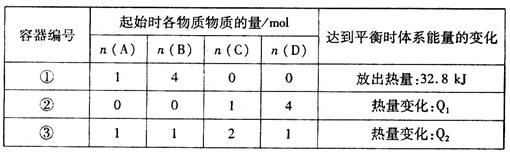
下列说法中,不正确的是
A.若容器①中反应10min达到平衡,0~10min时间内,用A表示的平均反应速率v(A)=4.0×10-2mol/(L·min)
B.平衡时,①与②容器中A的体积分数相等
C.③达平衡时体系能量的变化主要为热能转化为化学能
D.容器③中,开始时v(B)生成>v(B)消耗
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
| A.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 |
| B.气态氢化物的热稳定性:M>N |
| C.M与X的化合物对应的水化物一定是强酸. |
D.离子半径 |
丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是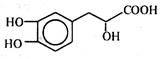
| A.丹参素的分子式为C9H10O5 |
| B.1 mol丹参素最多可以和4 mol H2发生加成反应 |
| C.1 mol丹参素在一定条件下与足量金属钠反应可生成2 mol H2 |
| D.丹参素能发生取代、中和、氧化反应等反应 |
下列说法正确的是
| A.乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 |
| B.二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同 |
| C.Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关 |
| D.7.8g过氧化钠含有的共用电子对数为0.1NA |
选做(12分)【化学——有机化学基础】有机化合物F的合成路线如下:
已知: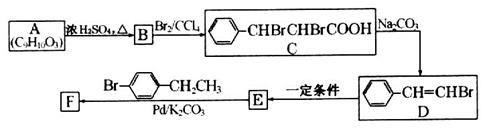
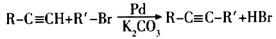
(1)A中含氧官能团的名称是____________。
(2)在B的同分异构体中,符合下列条件的同分异构体有________种;其中核磁共振氢谱有6组峰的是______(写结构简式)。
①属于芳香族化合物
②能发生水解反应
③能与溴水发生加成反应
(3)写出C与足量NaOH溶液在加热条件下反应的化学方程式:_____________________
(4)由D生成E的反应条件是____________________________。
(5)F的结构简式为______________________________________。