有5 种 短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合
短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合 物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列
物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列 问题:
问题:
(1)写出五种元素的名称:A B C D E 。
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质 ;B与E形成的化合物 ;
A、B、E 形成的化合物 ;D、E形成的化合物
形成的化合物 ;D、E形成的化合物
铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1)Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝酸反应制备,主要流程如下: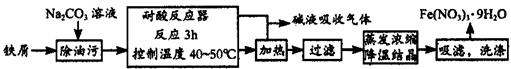
①Na2CO3溶液可以除油污,原因是(用离子方程式表示)_________________________;
②耐腐反应器中可以观察到如下的现象:铁屑__________,溶液颜色变为__________,有______色气体产生;制备过程中需控制加入铁屑的量,当观察到_______________的现象时应停止加入铁屑;
③制得的Fe(NO3)3·9H2O用20% HNO3洗涤,其原因是_________________________。
④若在实验中进行蒸发浓缩、降温结晶的操作,除带铁圈的铁架台、坩埚钳外,还需要的主要仪器有___________。
(2)某兴趣小组在实验室用细铁屑和稀硝酸制备Fe(NO3)3,装置如右图所示(固定所用仪器和加热装置未画出)。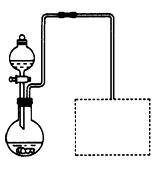
①该实验中对圆底烧瓶加热的最佳方式用_ _________加热;
_________加热;
②装置中圆底烧瓶上方长导管的作用是_________________;
③请在图中虚线框内画出防止倒吸的尾气吸收装置。(提示:碱液可快速、充分吸收产生的氮的氧化物气体)
A是生产某新型工程塑料的基础原料之一,其组成元素为C、H、O,其分子结构模型如图所示(图中球与球之间连线代表化学键,不一定表示单键)。

(1)根据分子结构模型写出A的结构简式______________________________。
(2)写出反应类型:反应①、⑤分别属于_______________、_______________。
(3)B与F均能与溴水中的溴发生加成反应,F的结构简式为______________________。
写出反应⑥的化学方程式(注明必要的反应条件)______________________________。
(4)已知G有多种芳香族同分异构体,其中符合下列条件的同分异构体共有___________种。
①能与稀硫酸及NaOH溶液反应
②能发生银镜反应
③分子中有一个甲基
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA |
NaOH |
混合溶液的pH |
| 甲 |
[HA]=0.2 mol·L-1 |
[NaOH]="0.2" mol·L-1 |
pH=a |
| 乙 |
[HA]=c1 mol·L-1 |
[NaOH]="0.2" mol·L-1 |
pH=7 |
| 丙 |
[HA]="0.1" mol·L-1 |
[NaOH]="0.1" mol·L-1 |
pH=9 |
| 丁 |
pH=2 |
pH=12 |
pH=b |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?
(2)c1(填“<”、“>”或“=”)0.2 mol·L-1。乙组实验中HA和NaOH溶液混合前,HA溶液中[A-]与NaOH溶液中[Na+]的关系是(从下面选项中选择填空)
| A.前者大 | B.后者大 | C.二者相等 | D.无法判断 |
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是,其中,[A-]=mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前[HA] (填“<”、“>”或“=”)[NaOH], b 7(填“<”、“>”或“=”)
现有反应:CO(g)+ H2O(g)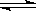 CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K_____1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大小”、“小于”或“等于”)。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用下图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁: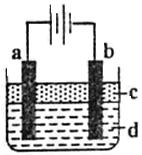
(1)a极材料为,a电极反应式为。
(2)电解液d可以是,则白色沉淀在电极上生成;电解液d也可以是,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是,在加苯之前对d溶液进行加热煮沸处理,目的是。
(4)为了在短时间内看到白色沉淀,可以采取的措施是。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极
上看到的气泡外,另一明显的现象为。