在蒸发发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体是
| A.氯化镁铝溶液 | B.硫酸亚铁溶液 | C.碳酸氢钠溶液 | D.硫酸铝溶液 |
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题: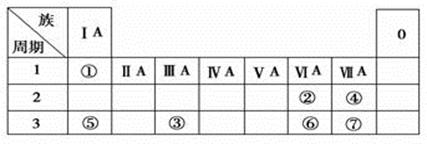
(1)④、⑤、⑦的原子半径由大到小的顺序为(用化学用语表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。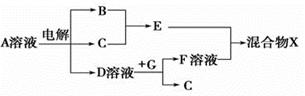
①写出D溶液与G反应的化学方程式:。
②写出检验A溶液中溶质的阴离子的方法:。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液中的c(OH - ) =10-2 mol/L (忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量的NaOH溶液,③加适量的盐酸,④加过量的碳酸钠溶液,⑤加过量的氯化钡溶液。正确的操作顺序是
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
海水中含有MgCl2,从海水中提取镁,正确的方法是
A.海水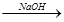 Mg(OH)2 Mg(OH)2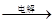 Mg Mg |
B.海水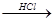 MgCl2溶液→ MgCl2(熔融) MgCl2溶液→ MgCl2(熔融)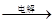 Mg Mg |
C.海水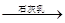 Mg(OH)2 Mg(OH)2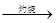 MgO MgO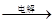 Mg Mg |
D.海水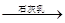 Mg(OH)2 Mg(OH)2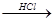 MgCl2溶液 → MgCl2(熔融) MgCl2溶液 → MgCl2(熔融)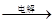 Mg Mg |
人类对某金属冶炼技术的掌握程度决定了其应用的广泛性。影响冶炼方法的主要因素是
| A.金属的活动性大小 | B.金属在地壳中的含量多少 |
| C.金属的化合价高低 | D.金属的导电性强弱 |
将1mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101 kPa,120℃),其总质量为72 g,下列有关叙述不正确的是
| A.产物的平均摩尔质量为24 g/mol |
| B.若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则压强变为原来的1/3 |
| C.反应中消耗的氧气为56 g |
| D.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收 |