电镀前,把铁制品放入稀盐酸中浸泡,以除去表面的铁锈。其除锈的化学方程式为: ,如果浸泡时间太长会有气泡产生,该化学方程式为: 。
实验探究氢气遇到氧气发生爆炸的条件:
(1)甲装置中仪器“A”的名称是;在实验室中利用氯酸钾和二氧化锰制取氧气,发生的化学方程式是;利用锌粒和稀硫酸制取氢气,可以利用下列(选填“甲”或“乙”)装置;
(2)利用丙装置将氢气、氧气混合气体收集起来,可以观察数量,通过活塞控制两者气体的比例关系,利用一次性保鲜袋收集混合气体,然后直接点燃保鲜袋。
(3)实验共四次,实验数据及现象记录在下表:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 氢气与氧气的体积比 |
1︰2 |
1︰4 |
1︰19 |
1︰39 |
| 氢气的体积百分数 |
33% |
20% |
5% |
3.3% |
| 点燃后现象 |
爆炸 |
爆炸 |
爆炸 |
保鲜袋燃烧,没有爆炸 |
由此可见氢气与氧气混合发生爆炸,除要达到燃烧的三个条件外,还和有关。
水是非常良好的溶剂,是生活、生产中最重要的物质,请回答下列问题:
(1)KNO3溶于水后得到的溶液,具有稳定性和性。根据如图所示的KNO3和NaCl的溶解度曲线回答下列问题。
(2)50℃时,KNO3的溶解度(填“大于”、“等于”或“小于”)NaCl的溶解度;
(3)10℃时,KNO3的溶解度约为;
(4)在温度不变的情况下,将NaCl的不饱和溶液变成饱和溶液,可采用恒温蒸发水和的方法。
(5)在40℃时,将质量分数相等的KNO3和NaCl溶液,冷却到20℃,此时有关它们质量分数的关系,下列说法错误的是(选填编号)
A.可能KNO3溶液质量分数大
B.可能NaCl溶液质量分数大
C.两者可能仍旧相等
“达菲”是目前世界上治疗H1N1流感病毒的良药。生产“达菲”的主要原料是莽草酸,可从茴香中提取。如图为莽草酸理化性质的描述。回答下列问题: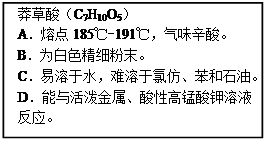
(1)莽草酸物质中,共有种元素,其中氢、氧两种元素的质量比为,碳、氧原子的个数之比为。
(2)其中属于化学性质的是(填图中序号)。
(3)莽草酸的摩尔质量是g/mol。
氧气是我们身边常见的物质,请回答以下问题:
(1)写出实验室利用双氧水分解制取氧气的化学方程式;
(2)将硫粉在空气中燃烧,除见到淡蓝色火焰外,还具有的现象是,并写出该反应的化学方程式;
(3)我们生活离不开氧气,但是某些方面氧气也给生活、生产造成不利的一面,请写出一条有关氧气不利的一面。
(4)实验室制取氧气,利用的化学反应常常是分解反应,而不会是化合反应,理由是。
生活离不开化学,化学与生活息息相关.
(1)均衡膳食有益健康.下列食物中,富含蛋白质的是 (填字母序号).
(2)为了全民的健康,我国推广使用强化铁酱油,这里的“铁”指的是 (填“单质”、“元素”或“分子”).人体缺铁会引起 .
(3)吸烟有害健康.香烟烟气中含有几百种对人体有害的物质,如尼古丁、焦油、一氧化碳、二氧化碳等,其中与血红蛋白结合能力强的有毒气体是 .