氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为____ _____。
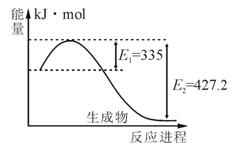
|
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递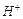 )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2
)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,则在电化学合成氨的过程中,阴极反应式为___ ______。
2NH3,则在电化学合成氨的过程中,阴极反应式为___ ______。
 2NH3(g)
2NH3(g)| t / K |
298 |
398 |
498 |
…… |
| K / (mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①写出Km的表达式 ,判断K1的相对大小,K1_______4.1×106 (填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B. v(N2)(正) = 3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
E. 浓度积Q=K时
(4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是 。
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为( )
A.C(Cl-)>C(NH4+)>C(H+)>C(OH-)
B.C(NH4+)>C(Cl-)>C(OH-)>C(H+)
C.C(Cl-)>C(NH4+)>C(OH-)>C(H+)
D.C(NH4+)>C(Cl-)>C(H+)>C(OH-)
(14分)X、Y、及W是短周期中的四种元素,其原子序数依次增大。相关信息如下表
| 元素 |
相关信息 |
| X |
具有多种同素异形体,形成的化合物种类繁多 |
| Y |
短周期主族元素中原子半径最大 |
| Z |
位于元素周期表金属与非金属元素的分界线上,最高化合价为十4 |
| W |
富集在海水中的元素,它的某些化合物常用作消毒刹 |
(1)Z元素基态原子的核外电子排布式为,其未成对的电子数目为。
(2)Y位于元素周期表中第周期,第族,四种元素的电负性由大到水的顺序是(写元素符号)。
(3)氢化物中X-H和W-H的化学键极性较强的是,耐磨材料(XY)和单质y 熔点较高的
是(均用元素符号表示)。
(4)已知400 ℃时,HW 可被氧气催化氧化生成W 的单质,从而实现化更生产上W的循环利用。若断开1mo1H一W化学键,该反应放热28.9KJ,试写出相应的热化学方程式:。
在下图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极。
(1)断开K2接通K1时,a为_________极,b电极上的电极反应式为___________________
(2)断开K1接通K2时,a为__________极,该电极上的电极反应式为____________________,一段时间后,溶液的pH_________________(填“增大”,“减小”或“不变”)
【化学一一选修物质结构与性质】
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物, D与B可形成离子化合物其晶胞结构如图所示。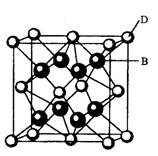
请回答下列问题。
(1)E元素原子基态时的价电子排布式为;
(2)A2F分子中F原子的杂化类型是;
(3)C元素与氧形成的离子CO2-的立体构型是__________;写出一种与CO2-互为等电子体的分子的分子式________;
(4)将E单质的粉末加入CA3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是______________________________________________________;
(5)从图中可以看出,D跟B形成的离子化合物的化学式为;若离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(写出表达式即可)。
选考题【化学一一选修化学与技术】以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下: 
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Zn2+ |
5. 2 |
6. 4 |
| Fe2+ |
5. 8 |
8. 8 |
(1)加入H2O2溶液发生反应的离子方程式为。
(2)流程图中,为了降低溶液的酸度,试剂X不可以是(选填序号:
a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3;d.ZnSO4;pH应调整到;
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为,聚乳酸的结构简式为;
Ⅱ、制取金属锌采用碱溶解ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq),然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为;阴极的电极反应为;
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是。
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH3OCH3(g)的反应热为;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
______(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将
________(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将__________;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为____________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示: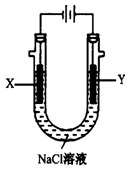
请写出电解过程中Y电极附近观察到的现象;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH=(假设溶液的体积不变,气体全部从溶液中逸出)。