(14分)X、Y、及W是短周期中的四种元素,其原子序数依次增大。相关信息如下表
| 元素 |
相关信息 |
| X |
具有多种同素异形体,形成的化合物种类繁多 |
| Y |
短周期主族元素中原子半径最大 |
| Z |
位于元素周期表金属与非金属元素的分界线上,最高化合价为十4 |
| W |
富集在海水中的元素,它的某些化合物常用作消毒刹 |
(1)Z元素基态原子的核外电子排布式为 ,其未成对的电子数目为 。
(2)Y位于元素周期表中第 周期,第 族,四种元素的电负性由大到水的顺序是 (写元素符号)。
(3)氢化物中X-H和W-H的化学键极性较强的是 ,耐磨材料(XY)和单质y 熔点较高的
是 (均用元素符号表示)。
(4)已知400 ℃时,HW 可被氧气催化氧化生成W 的单质,从而实现化更生产上W的循环利用。若断开1mo1H一W化学键,该反应放热28.9KJ,试写出相应的热化学方程式: 。
【化学——选修3:物质结构与性质】(15分) 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价电子(外围电子)排布式为______________________________。
(2)硝酸钾中NO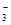 的空间构型为________,写出与NO
的空间构型为________,写出与NO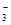 互为等电子体的一种非极性分子化学式____________________________________。
互为等电子体的一种非极性分子化学式____________________________________。
(3)6氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有____________。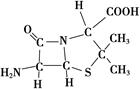
(4)下列说法正确的有________(填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(┌└CH2CH2┐ ┘n)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)===SiO2(s)中,每生成60 g SiO2放出的能量为(2c-a-b) kJ
| 化学键 |
Si—Si |
O==O |
Si—O |
| 键能(kJ·mol-1) |
a |
b |
c |
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式______________________________________。若两个最近的Fe原子间的距离为s cm,则该晶体的密度是________________________________g·mol-1。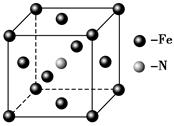
【化学—物质结构与性质】
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列。
回答下列问题:
(1)Z+的核外外围电子排布式是_________________________________________________。
(2)X以及与X左右相邻的两种元素,其第一电离能由由大到小的顺序为____________(填元素符号)。
(3)Q元素最高价氧化物的水化物分子中,Q原子采取________杂化,写出与QR2互为等电子体的一种分子的化学式:____________________。
(4)分子式为G 2R、G 2Y的两种物质中一种更稳定,原因是________________________;Q的氯化物、T的氯化物、X的氯化物的熔点由低到高的顺序是___(填化学式)。
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如下图所示。晶体中距每个X原子周围距离最近的Q原子有个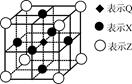
【化学—化学与技术】
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于__________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为__________,原因是______________________________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换树脂的__________起离子交换作用。当阴离子交换树脂失效后可放入___________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题: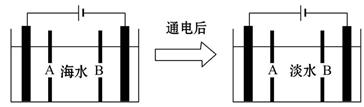
①阳离子交换膜是指_________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_____________________________;
阴极区的现象是:_____________________________________________。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)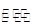 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)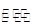 2SO3(g)的正反应为反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
2SO3(g)的正反应为反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
②若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1_______K2;若反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
右图是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______________。(ΔH的数值用含字母a、b的代数式表示)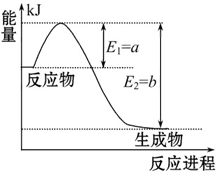
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25 ℃下, 2.0×10-3 mol·L-1的NaCl溶液中逐滴加入适量的2.0×10-4 mol·L-1硝酸银溶液,白色沉淀生成(填“有”、“没有”)。通过计算解释原因______________________________,向反应后的浊液中,继续加入2.0×10-3mol·L-1的NaI溶液,看到的现象是_____________________________,产生该现象的原因是_____________(用离子方程式表示)。(已知25 ℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16)
[物质结构与性质]
物质结构的多样性让人类使用的材料精彩纷呈。
(1)图是原子序数相连的七种短周期元素第一电离能示意图。其中硼元素是(填图中元素代号)。
(2)②③两种元素组成的化合物与③④两种元素组成的化合物为等电子体,写出与其等电子体的一种离子化学式
(3)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为 草酸钠晶体中存在(填图中元素代号)。
草酸钠晶体中存在(填图中元素代号)。
A金属键 B非极性键 C键 D范德华力 E氢键 F离子键
(4)含氧酸可电离的氢原子来自羟基,碳酸的结构式可表达为;若碳酸 中的碳氧原子都在同一平面,则碳原子的杂化类型是。
(5)PtCl4和氨水反应可获得PtCl4• 4NH3,PtCl4•4NH3是一种配合物。100mL0.1mol•L-1PtCl4•4NH3 溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀。该配合物溶于水的电离方程式为。