有A、B、C、D四种金属分别用导线两两相连浸入电解液中组成原电池。A、B相连时,A为负极;C、D相连时,电流由D流到C;A、C 相连时,C极上有大量气泡;B、D相连时,D极发生氧化反应。据此判断四种金属的活动性顺序是
A.A>C>D>B B.D>A>B>C C.A>D>C>B D.C>B>A>D
某二价阳离子含24个电子,它的质量数为59,则该离子核内中子数是
| A.22 | B.26 | C.33 | D.35 |
下列各组物质关系中,与O2和O3关系相同的一组是
| A.Na和Na+ | B.金刚石和石墨 | C.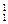 H和 H和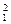 H H |
D.水和重水 |
酸雨形成的主要原因是人们向空气中排放了大量的
| A.二氧化硫 | B.二氧化碳 | C.一氧化碳 | D.硫化氢 |
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是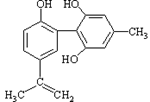
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B .滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
已知两分子乙醛可发生下列反应:CH3CHO +CH3CHO→CH3-CH-CH2 CHO,则乙醛与丙醛的混合物发生上述加成反应的产物有
| A.2种 | B.3种 | C.4种 | D.5种 |