氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是
| A.H2通入负极区 | B.O2通入正极区 |
| C.负极反应为2H2 + 4OH- — 4e- = 4H2O | D.正极发生氧化反应 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,
以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,
2Z(g)的平衡常数为1 600。此温度下,
在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下: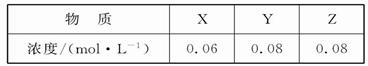
下列说法正确的是
| A.此时v(正)<v(逆) |
| B.平衡时Y的浓度为0.05 mol·L-1 |
| C.平衡时X的转化率为40% |
| D.增大压强使平衡向正反应方向移动,平衡常数增大 |
下列描述中,不符合生产实际的是
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用石墨作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
| A.a=3 | B.a=2 |
| C.B的转化率为40% | D.B的转化率为60% |
下列叙述中不正确的是
| A.电解池的阳极上发生氧化反应,阴极上发生还原反应 |
| B.不能自发进行的氧化还原反应可通过电解的原理实现 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 |