(14分)主族元素A、 B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
⑴写出元素符号A , D 。
写出B阴离子结构示意图 ;
写出C元素在周期表中的位置第 周期 族;
⑵写出C在足量B中充分反应后生成物的电子式 ,结构式 。
⑶写出B、D在加热条件下形成化合物的电子式 ,
判断其中的化学键的类型 。
用电子式表示B、D在不加热条件下形成化合物的形成过程 。
⑷写出一种有A、B、C、D组成的化合物的化学式 。
已知元素A和B的原子序数都小于18,A元素原子的最外层电子数为a,次外层电子数为b,B元素M层电子数为 a-b,L层电子数为 a+b。请完成下列问题:
(1) 元素A在周期表中的位置
(2) 元素A的原子结构示意图
(3) 元素B的单质的一种用途
(4) 用B的氧化物的一种用途
(5) B元素的氧化物与NaOH溶液反应的化学方程式
写出下列反应的化学方程式,并指出氧化剂和还原剂。
(1)锂在空气中燃烧
(2)钾与水反应
(3)镁条在二氧化碳气体中燃烧
(4)曾青得铁则化为铜——湿法炼铜
(5)从赤铁矿中提炼铁——工业冶铁
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国 家的石油化工发展水平,A还是一 种植物生长调节剂,A可发生如图所示的一系列化学反应, 其中①②③属于同种反应类型。根据如图回答下列问题: 
(1)写出D、E的结构简式:
D, E 。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
② 、反应类型。
⑤ 、反应类型。
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系: Cr2O72- + H2O 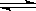 2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈____色,因为。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈色, 因为。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡,溶液颜色将。
已知:H+(aq)+OH-(aq)= H2O(l)ΔH="-57.3" kJ/ mol,计算下列中和反应中放出的热量:
(1)用20 g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出kJ的热量。
(2)用0.1 mol Ba(OH)2配成的稀溶液跟足量的稀硝酸反应,能放出kJ的热量。
(3)用1 mol醋酸稀溶液和足量NaOH稀溶液反应,放出的热量(填“大于”、“小于”或“等于”)57.3 kJ,理由是。
(4)1 L 0.1 mol/L NaOH溶液分别与①醋酸溶液、②浓硫酸、③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ)。则它们由大至小的顺序为。