常温下,在溶液中可以发生反应: ,则下列解释正确的是
,则下列解释正确的是
①X被氧化 ②X是氧化剂 ③X具有还原性
④ 是氧化产物 ⑤
是氧化产物 ⑤ 具有还原性 ⑥
具有还原性 ⑥ 的氧化性比
的氧化性比 强
强
| A.②⑤ | B.②④⑥ | C.①③④ | D.①③⑤⑥ |
下列反应中符合图象的是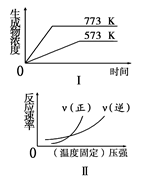
A.N2(g)+3H2(g)  2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3( g)  2SO2(g)+O2(g) ΔH>0 2SO2(g)+O2(g) ΔH>0 |
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
D.H2(g)+CO(g)  C(s)+H2O(g) ΔH>0 C(s)+H2O(g) ΔH>0 |
已知:2 CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol根据以上热化学方程式判断,下列说法错误的是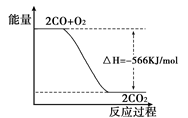
| A.CO2气体分解生成CO气和O2气体的反应是放热反应 |
| B.CO气体与O2气体生成CO2气体的反应是放热反应 |
| C.上图可表示由CO气体生成CO2气体的反应过程和能量关系 |
| D.在相同条件下,2 mol CO气体与1 mol O2气体的能量总和大于2 mol CO2气体的能量 |
用已知物质的量浓度的NaOH溶液测定未知物质的量浓度的盐酸,其操作错误的是
| A.酸式滴定管需用待测盐酸润洗 |
| B.碱式滴定管不用标准碱液润洗 |
| C.滴定过程中不能有液体从锥形瓶溅出 |
| D.滴定结束,读数时要平视读数 |
在固定体积的容器内进行反应2HI(g) 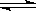 H2(g) + I2(g),达到 平衡状态的标志是
H2(g) + I2(g),达到 平衡状态的标志是
| A.I2(g)的消耗速率等于H2的消耗速率 |
| B.容器中各组分的浓度不随时间变化 |
| C.容器内气体的压强不再变化 |
| D.单位时间内生成n mol H2,同时生成n mol HI |
已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10 mol·L-1、Ka(HF)= 6.8×10-4 mol·L-1、Ka(CH3COOH)= 1.8×10-5 mol·L-1、、Ka(HNO2)= 6.4×10-6mol·L-1。则物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
| A.NaCN | B.NaF | C.CH3COONa | D.NaNO2 |