依据氧化还原反应: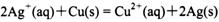 设计的原电池如图所示。下列
设计的原电池如图所示。下列
有关说法中错误的是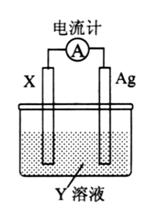
| A.电解质溶液Y是CuSO4溶液 |
| B.电极X的材料是Cu |
C.银电极为电池的正极,其电极反应为: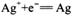 |
| D.外电路中的电子是从X电极流向Ag电极 |
某温度下,向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为( )
2SO3(g)的平衡常数为( )
| A.3.2×103 | B.1.6×103 | C.8.0×102 | D.4.0×102 |
图1为某化学反应的速率与时间的关系示意图。下列有关t1时刻改变条件的说法正确的是()
A.2SO2(g)+O2(g)  2SO3(g) ΔH<0,t1时刻升高温度 2SO3(g) ΔH<0,t1时刻升高温度 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度 |
C.H2O(g)+CO(g)  H2(g)+CO2(g)ΔH>0, t1时刻增大压强 H2(g)+CO2(g)ΔH>0, t1时刻增大压强 |
D.C(s)+H2O(g) CO(g)+H2(g)ΔH>0,t1时刻升高温度 CO(g)+H2(g)ΔH>0,t1时刻升高温度 |
将CoCl2溶解于盐酸中可以形成CoCl42—,在溶液中存在下面的化学平衡:
Co2+(aq)+4Cl-(aq) CoCl42—(aq) ΔH>0
CoCl42—(aq) ΔH>0
粉红色蓝色
下列说法正确的是( )
| A.升高温度,正反应速率增大,逆反应速率减小 |
B.该反应的平衡常数 |
| C.将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为红色 |
| D.增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小 |
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
| A.c1∶c2=3∶1 |
| B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
| D.X、Y的转化率相等 |
进行如下实验,在A锥形瓶中放入10g块状CaCO3,在B锥形瓶中放入5g粉末状CaCO3,分别加入50mL2mol/L盐酸。下图中能正确表示实验结果的是()