某芳香烃X是一种重要的有机化工原料,有机化合物Y的分子式为 ,它们能按下图所示转化关系生成某种长效缓释阿司匹林(方框内物质均为有机物,无机产物已略去)。其中,E能使溴的四氯化碳溶液褪色,且分子中有1个甲基;G的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基,1 molG与足量金属钠作用产生H222.4 L(标准状况)。
,它们能按下图所示转化关系生成某种长效缓释阿司匹林(方框内物质均为有机物,无机产物已略去)。其中,E能使溴的四氯化碳溶液褪色,且分子中有1个甲基;G的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基,1 molG与足量金属钠作用产生H222.4 L(标准状况)。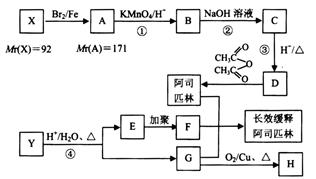
已知:
(i)阿司匹林又名乙酰水杨酸: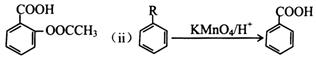
请回答:
(1) X的结构简式为__________, H分子中官能团的结构简式为__________;
(2) 反应②的化学方程式为__________,
反应①可否调至反应②、③之后进行?__________(选填“可以”或“不可以”),
请简述理由:___________________________________;
(3) 写出一种同时满足以下条件的D物质的同分异构体的结构简式_______________;
a.能发生银镜反应 b. 1个分子中含3个含氧官能团
c.苯环上一氯代物只有2种 d. 1mol有机物最多可消耗2mol NaOH
(4) 反应④的化学方程式为_______________;
(5) 阿司匹林、有机物F和G嫁接形成某种长效缓释阿司匹林,它能持续缓慢地释放出乙酰水杨酸,使人体能长时间存在乙酰水杨酸,用于抗血栓治疗。写出该长效缓释阿司匹林的结构简式_______________。
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3)X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种,)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
(6分)现代科技的高度快速发展离不开C和Si元素。
(1)写出Si的基态原子核外电子排布式__________________。
(2)从电负性角度分析,C、Si、O元素的非金属活泼性由强至弱的顺序为______。
(3)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为_____,微粒间存在的作用力是_______。
(4)C、Si为同一主族的元素,CO2、SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成上述π键,而Si、O原子间不能形成上述π键:_________________________
A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
| 元素符号 |
元素性质或原子结构 |
| A |
A是形成化合物最多的元素 |
| B |
B元素的单质在空气中含量最多 |
| C |
C元素在地壳中含量最多 |
| D |
D元素在同周期中金属性最强 |
| E |
常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置;
(2)B的最简单气态氢化物分子空间构型;其沸点高于同主族的其它气态氢化物原因;
(3)D的最高价氧化物对应水化物的化学键类型;
(4)B、C、D、E简单离子半径大小(用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式.
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为____________________________________________。
(2)又知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________。
下表列出了周期表短周期中6种元素的有关数据:
| 元素编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 原子半径(nm) |
0.075 |
0.110 |
0.152 |
0.071 |
0.186 |
0.099 |
| 最高价态 |
+5 |
+5 |
+1 |
0 |
+1 |
+7 |
| 最低价态 |
﹣3 |
﹣3 |
0 |
﹣1 |
0 |
﹣1 |
根据上表信息填空:
(1)写出下列编号对应元素的元素符号:②,③.
(2)元素④在周期表中的位置是.
(3)元素⑤形成的两种常见氧化物的化学式分别为、,其中都含有的化学键是.
(4)①的氢化物和⑥的氢化物反应的化学方程式为.