金属的防腐常用方法有
| A.覆盖油漆 | B.覆 盖塑料 盖塑料 |
C.电镀金属 |
D.电化学保护法 E.制成不锈钢 E.制成不锈钢 |
请为以下钢铁制品选择一种适当的防止生锈的方法(填写序号):
(1) 邮筒___ ___ ___ (2) 手术刀_____ ___
(3) 海水中的钢闸门________ (4) 电线____ ______
(5) 自行车的钢圈____________。
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
⑴在这些元素中,化学性质最不活泼的原子的原子结构示意图为
⑵在这些元素中,地壳中含量最多的金属元素是
⑶用电子式表示②与④形成化合物的过程 。
⑷这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是,呈两性的氢氧化物是
⑸写出⑤与氢氧化钠溶液反应的化学方程式: 。
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
⑹某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L。则HXR的相对分子量为 ;HXR的化学式为 。
(4分)下面列出了几组物质,请将物质的合适组号填写在空格上。互为同位素的是,互为同分异构体的是,互为同系物的是,互为同素异形体的是。
①金刚石与“足球烯”C60;②D2O与T2O;③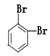 和
和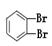
④CH4和CH3CH2CH3;⑤葡萄糖与果糖;⑥16O和18O
下列叙述正确的是
| A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| C.常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D.16 g CH4与18 g NH4+所含质子数相等 |
(第一个空1分,其它每空2分,共9分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。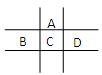
回答下列问题:
(1)B的元素名称为,D在周期表中的位置。
(2)A,C,D对应的离子半径由大到小顺序为,(用化学符号表示)
(3)D的单质与水反应的离子方程式为_。
(4)向D与E形成的化合物的水溶液中滴入过量烧碱溶液,用离子方程式表述
。
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式:正极:;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
该反应的反应方程式可表示为,平衡时Y气体的转化率。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量。