 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(2)B→C的反应类型是 。
(3)E的结构中除含有羟基外还含有的含氧官能团的名称为 。
(4)写出F和过量NaOH溶液共热时反应的化学方程式: 。
(5)下列关于G的说法正确的是
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
(6)与D互为同分异构体且含有酚羟基、酯基的有 种
已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为:,它的共价键属于(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:_________________________ ;
X与W形成的化合物与水反应时,水作的是(填:氧化剂、还原剂)。
城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式____________________________.
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为
C3H8(g) +5O2(g) ==3CO2(g) + 4H2O(l);△H=–2220.0 kJ· ,
,
又知CO气体燃烧的热化学方程式为:
CO(g) +1/2O2(g) ==CO2(g) ;△H=–282.57kJ· ,
,
试比较同质量的C3H8和CO燃烧,产生的热量比值约为_________:1。
(3)已知氢气燃烧的热化学方程式为2H2(g) + O2(g) ==2H2O(l);△H=–571.6 kJ· ,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
(4)氢气是未来的能源,除来源丰富之外,还具有的优点是____________________
在利用镁条与醋酸的反应研究化学反应速率的影响因素的实验中,同学们记录了相同体积、不同浓度的醋酸与足量Mg条反应,产生H2体积随时间变化的数据,并以单位时间内产生H2的体积来表示反应速率,其反应速率随时间变化的图(如图所示)。
(1)在a、b、c、d四条曲线中,对应醋酸溶液的物质的量浓度最小的是_________,反应最后产生的H2在相同条件下体积最大的是_____________。
(2)在d曲线中,反应一段时间以后,反应速率出现反常的升高的现象(x点附近)。产生这种现象的原因主要是____________。
取两支试管各加入5mL 0.1 mol/L Na2S2O3和5mL0.1molH2SO4,试管①放入冷水中,试管②放入热水中,试管_______(填①或②)中先产生明显的实验现象,离子反应方程式为_______________________________。
检查装置气密性是化学实验中的重要操作之一。试按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是(填序号,下同)。
A.容量瓶 B.洗气瓶 C.分液漏斗 D.酸(碱)式滴定管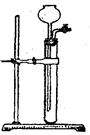
(2)下列关于不进行气密性检查可能导致后果的叙述中,正确的是。
A.收集不到气体
B.造成环境污染
C.观察到的实验现象有误
D.引发爆炸事故
(3)检查右图所示简易气体发生装置的气密性操作是:___________
(4)该装置能做到关闭活塞,随后反应停止。它的原理是:_________