传统制取甲醇的原理是CO(g)+ 2H2(g) CH3OH(g) ---------①
CH3OH(g) ---------①
25℃时,K=2.68×1022
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下: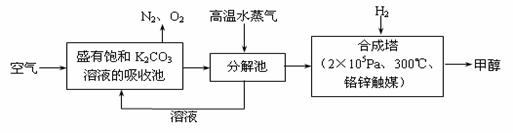
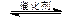 反应原理为①CO2(g)+3H2(g) CH3OH(g)+H2O(g)------------------②
反应原理为①CO2(g)+3H2(g) CH3OH(g)+H2O(g)------------------②
25℃时,K=3.96×1011
回答:
(1)相同条件下,反应①与反应②相比,转化率更大的是 ,(用①②回答)
(2)写出反应②的平衡常数表达式K= ,
(3)在30MPa压强下,测得反应②的实验数据如下表。分析表中数据回答下列问题:
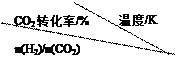 |
500 |
600 |
700 |
800 |
| 1.5 |
45 |
33 |
20 |
12 |
| 2.0 |
60 |
43 |
28 |
15 |
| 3.0 |
83 |
62 |
37 |
22 |
温度升高,K值 (填“增大”、“减小”、或“不变”)。反应的△H 0(填>、=、<)
(4)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。(设合成塔为密闭容器)
| A.升高温度 | B.充入He(g) |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
(5)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如下图所示: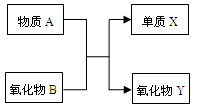
请回答下列问题:
(1)若A为金属单质,B为非金属氧化物,则该反应的化学方程式为;请写出质量数为26的A的一种核素符号。
(2)若A为非金属单质,B为非金属氧化物,且A、X为同主族元素,则该反应的化学方程式为。
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在该反应中,还原剂是。
(2)若在反应中生成了标况下2.24L氯气,则电子转移的个数是NA。
现有A、B、C、D四种元素,它们的质子数依次增多。①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;③C+离子比B3+离子多8个电子;④C与D元素可以形成化合物CD;⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)写出C.D 的名称:C:;D:
(2)A在周期表中的位置。
(3)写出B2A3与氢氧化钠溶液反应的离子方程式。
(4)比较B、C二种元素形成的简单离子半径的大小(用离子符号表示):离子半径:。
写出下列物质的电离方程式:
H2SO4
Ba(OH)2
Na2SO4
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取 |
| B.升华 |
| C.结晶 |
| D.分液 |
E.蒸馏
F.过滤
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。