下图中A—J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去)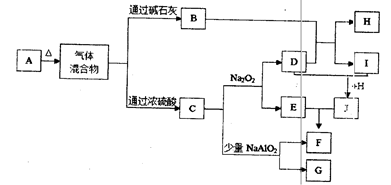
(1)若A加热后得到等物质的量的B和C,则A的化学式为 。
(2)实验室检验B的方法是 。
(3)写出上述由I生成J的化学方程式 。
(4)写出C和少量NaAlO2溶液反应的离子方程式 。
(5)由H所含的两种元素组成的18电子微粒的电子式为 。
(6)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择 (填代号);
A.石灰石 B.稀HNO3 C.稀H2SO4 D.稀HCl E.纯碱
所需气体发生装置是 (填代号);所选装置中涉及到的玻璃仪器的名称为 。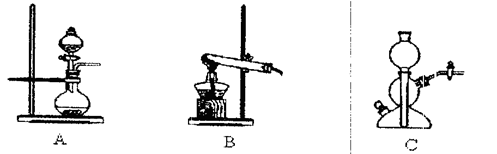
依据题目要求回答下列问题。
(1)常温下,浓度均为0.lmol·L-1的下列六种溶液的pH如下表: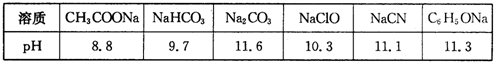
①上述盐溶液中的阴离子,结合H+能力最强的是
②根据表中数据,浓度均为0.0lmol·L-1的下列五种物质的溶液中,酸性最强的是(填编号);将各溶液分别稀释100倍,pH变化最小的是(填编号)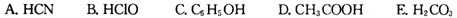
③据上表数据,请你判断下列反应不能成立的是(填编号)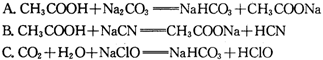
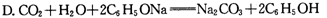
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为。
(2)已知常温下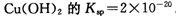 。又知常温下某CuSO4溶液里
。又知常温下某CuSO4溶液里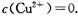
02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于____.
(3)已知可逆反应 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式:____。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度(选填“增大”“减小”或“不变”);当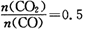 ,混合气体平均相对分子质量为。
,混合气体平均相对分子质量为。
为防止碘缺乏病,通常在食盐中添加少量碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应。请配平化学方程式,用双线桥标出电子转移的方向与数目。
□KI+□KIO3+□H2SO4——□I2+□K2SO4+□H2O
此反应中,氧化剂是,还原剂是。
现有金属单质A、B 、H、I和气体甲、乙、丙及物质C、D、E、F、G。其中B是地壳中含量第二的金属。他们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。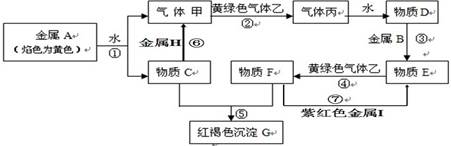
请根据以上信息回答下列问题:
⑴写出下列物质的化学式:B;乙。
⑵写出反应①的离子方程式:。
写出反应⑥的化学方程式:。
写出反应⑦的离子方程式:。
⑶实验室检验物质F中阳离子的常用试剂为。
选用下列物质填空(填序号)
①二氧化碳②二氧化硫③氮氧化物④氟氯昂
⑴会破坏臭氧层的物质是。
⑵过量会导致温室效应加剧的物质是。
⑶造成酸雨的物质是。
⑷导致光化学烟雾的物质是。
乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1) 当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=;
(2) 当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b=,得到的CO和CO2的物质的量之比n(CO):n(CO2)=。
(3) a的取值范围是;b的取值范围是。