ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: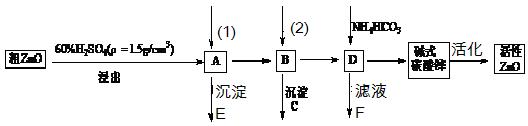
已知此溶液中Fe2+、 Fe3+、 Cu2+ 、 Zn2+形成氢氧化物的pH如下表
| 离子 |
开始沉沉淀的pH |
完全沉淀的pH |
| Fe2+ |
6.4 |
8.4 |
| Fe3+ |
2.4 |
3.1 |
| Cu2+ |
5.2 |
6.5 |
| Zn2+ |
6.8 |
9 |
(1)已知H2O2酸性溶液中能氧化Fe2+,反应的离子方程式为
(2)题目中框图中的(1)和(2)是需要加入的试剂依次是_______、_______。(用序号回答)
①ZnO ②H2O2较浓溶液 ③Na2CO3溶液
(3)加入试剂(2)应将杂质离子完全转化成沉淀C, 溶液的pH应控制在 ;
要实现该步骤中pH的控制,应使用 来检查溶液的pH
(4)书写碱式碳酸锌焙烧制备活性ZnO的化学方程式 .
(5)重晶石(主要成分BaSO4)是制备钡的化合物的重要原料,但BaSO4不溶于酸,工业上常常将其转化为BaCO3,再进一步制备其他钡的化合物。已知Ksp(BaSO4) = 1.0×10-10,Ksp(BaCO3) = 2×10-9。计算将BaSO4(s)转化为BaCO3(s)所需C(CO32-)应 mol/L
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2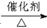 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。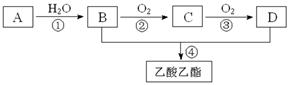
回答下列问题:
(1)A的结构式为。
(2)写出下列反应的反应类型:①,②,④。
(3)B、D分子中的官能团名称分别是、。
(4)除去乙酸乙酯中所混有少量的D杂质,所需试剂的名称是:。
(5)写出下列反应的化学方程式:(注明反应条件)
① ;
;
②;
④。
(6)若184gB和120gD反应能生成106gE,计算该反应的产率为。
(7)判定B能否直接被氧化为D,若能,指出所用的氧化剂是什么(若不能,此空不填);若不能请说明理由(若能,此空不填)。
A、B、C、D四种短周期元素,A、B同主族,C、D同周期。气体A2与气体C2按体积比2:1混和后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体。B的阳离子与C的阴离子的核外电子排布相同。D能形成自然界硬度最大的单质。请根据上述所提供的信息回答下列问题。
(1)写出A、B、C三种元素的名称:A;B ;C;D在周期表中的位置是。
(2)写出化合物B2C2的电子式。
(3)写出B2C2和A2C反应的离子方程式:。
(4)用电子式表示A2C形成的过程:。
(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(2)乙烷中含有乙烯除杂试剂为;
反应的化学方程式为。
(3)在10L密闭容器中充入2molA和1molB,发生的化学反应:3A(g)+B(g)  C(g)
C(g)
+2D(g),2min后反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的5/6,试填写下列空白:
①用气体B表示的2min内的平均反应速率为。
②平衡时,A的浓度为mol/L。
(4)我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。电池负极反应为,
正极反应。
将下列物质进行分类:①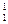 H与
H与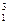 H②O2与O3③
H②O2与O3③ 乙醇与甲醚(CH3—O—CH3)④H2O与D2O⑤CH3CH2CH2CH2
乙醇与甲醚(CH3—O—CH3)④H2O与D2O⑤CH3CH2CH2CH2 CH3与CH3-CH(CH3)-CH3⑥C60与C70
CH3与CH3-CH(CH3)-CH3⑥C60与C70
(1)互为同位素的是(填编号、下同);
(2)互为同素异形体的是;
(3)互为同分异构体的是;
(4)互为同系物的是。
A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。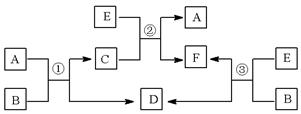
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为第ⅦA族元素单质。则A、D、E的氧化性由强到弱的顺序为(用化学式表示)________________________。
(2)若B是某元素R的氢化物,B的沸点大于与其同主族的其他元素氢化物的沸点,且B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应①的化学方程式___________________,③的化学方程式______________。
(3)若B由短周期元素X、Y组成,且X、Y原子个数比为1∶1,B晶体中既含离子键,又含非极性共价键;绿色植物的光合作用和呼吸作用可实现自然界中 D、E的循环。则B的电子式为_________________,反应①的离子方程式_____________________________。
D、E的循环。则B的电子式为_________________,反应①的离子方程式_____________________________。