通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C
键能/ kJ•mol—1 460 360 436 431 176 347
请回答下列问题:
⑴ 比较下列两组物质的熔点高低(填>或<)
SiC______ Si; SiCl4 ______ SiO2
⑵ 图立方体中心的“●”表示硅晶体中的一个原子, 请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取: SiCl4 (g) + 2H2(g) Si(s) + 4HCl(g);该反应的反应热△H = ___________ KJ/mol
化合物SOCl2是一种液态 化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消
化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消 失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
(1)根据上述实验,写出SOCL2和水反应的化学方程式 __.
__.
(2)AlCl3溶液蒸干灼 烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 __________________________ __________________.
烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 __________________________ __________________.
由短周期元素组成的 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)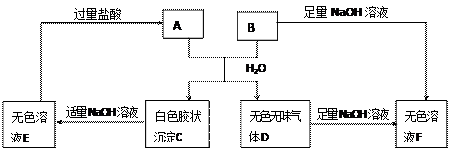
(1)A和B的混合物溶于水发生反应的离子方程式______________________________.
(2)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式__________________________________________________.
四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)①C元素在周期表中的位置, 请写出BC2分子的电子式____________。
②A元素的单质与物质甲发生反应的离子方程式___________________。
③以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,写出电池的电极反应式。负极__________;正极(2)A所在周期中, E元素的单质还原性最强,A、E单质反应得到的化合物M是一种重要的化工原料,如图是电解100ml饱和M溶液的装置,
X、Y都是惰性电极,实验开始时,同时在两边各滴入
几滴酚酞试液,则
①电解池中Y极上的电极反应式。
检验Y电极反应产物的方法是
②电解一段时间后,若阴极收集到112ml标准状况下的气体,
此时电解液的PH为(假设电解液的体积保持不变,常温下)
(14分)
Ⅰ.(每空1分) 已知某工业废水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。
(1)步骤1需用到的玻璃仪器除烧杯外有。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式),固体残渣的成分是(填化学式)。
(3)步骤3中涉及的操作是:蒸发浓缩、、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 。
Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO为SO)
(1)原溶液中肯定存在的离子是 ,肯定没有的离子是 ;
(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响 ;
(3)步骤②中发生反应的离子方程式为 、 .
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴煤的气化的主要化学反应方程式为:___________________________。
⑵煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)在某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)在某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。